Định luật bảo toàn khối lượng: Nguyên tắc cần nắm rõ
Bài viết này yeuhoahoc.edu.vn giải thích định luật bảo toàn khối lượng, phát biểu của nó, nội dung, ý nghĩa và cung cấp công thức cũng như một số bài…
Bài viết này yeuhoahoc.edu.vn giải thích định luật bảo toàn khối lượng, phát biểu của nó, nội dung, ý nghĩa và cung cấp công thức cũng như một số bài tập minh họa để giúp bạn hiểu rõ hơn về nguyên tắc quan trọng này trong hóa học.
Phát biểu định luật bảo toàn khối lượng
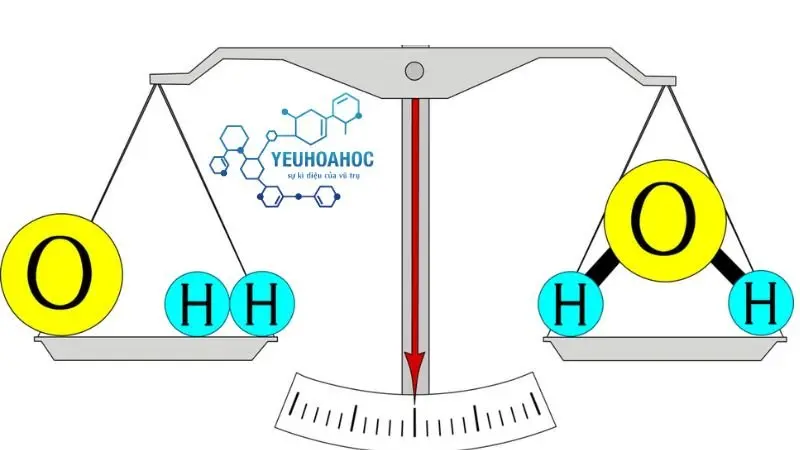
Định luật bảo toàn khối lượng, còn được gọi là định luật bảo toàn vật chất, là một trong những nguyên tắc cơ bản nhất trong hóa học. Định luật này phát biểu rằng: “Khối lượng không thể tạo ra hoặc biến mất trong các phản ứng hóa học; khối lượng của các chất tham gia vào phản ứng phải bằng khối lượng của các chất tạo ra sau phản ứng.”

Nội dung định luật bảo toàn khối lượng
Định luật bảo toàn khối lượng đặt ra một nguyên tắc quan trọng rằng trong bất kỳ phản ứng hóa học nào, tổng khối lượng của các chất tham gia vào phản ứng phải bằng tổng khối lượng của các chất sản phẩm tạo ra sau phản ứng. Điều này ngụ ý rằng nguyên tử không thể bị mất hoặc tạo ra từ hỏa hoạn, mà chúng chỉ tham gia vào các phản ứng để tạo ra các hợp chất mới.
Ý nghĩa định luật bảo toàn khối lượng
- Định luật này thể hiện tính chất bất biến của khối lượng trong hóa học và cung cấp một cơ sở chắc chắn cho các phản ứng hóa học.
- Nó giúp các nhà khoa học và hóa học gia xác định khối lượng chính xác của các chất tham gia và sản phẩm trong các phản ứng.
- Định luật này hỗ trợ trong việc tính toán và thiết kế các phản ứng hóa học, đặc biệt là trong công nghiệp và nghiên cứu khoa học.
Công thức định luật bảo toàn khối lượng
phương trình: A + B → C + D
Công thức định luật bảo toàn khối lượng có thể được biểu diễn như sau:
Trong đó:
- A, B là các chất tham gia trong phản ứng.
- C, D là các chất sản phẩm sau phản ứng.
là khối lượng của các chất tham gia.
là khối lượng của các chất sản phẩm.
Nếu trong một phương trình phản ứng có hai chất tham gia là A và B, và các sản phẩm là C và D, chúng ta có thể sử dụng định luật bảo toàn khối lượng để tính toán khối lượng của chất C:
A+B=C+D⇒C=A+B−D
Bài tập vận dụng
Dạng 1: Tính khối lượng chất tham gia hoặc sản phẩm phản ứng
Ví dụ: Cho 10 gam
tác dụng với dung dịch HCl dư, thu được khí
và dung dịch
. Xác định khối lượng khí
được sinh ra.
Lời giải:
Bước 1: Viết phương trình phản ứng:
Bước 2: Áp dụng định luật bảo toàn khối lượng, ta có:
Bước 3: Thay số vào phương trình, ta có:
Bước 4: Ta biết:
= 0,2 * 36,5 = 7,3 gam
= 0,1 * 111 = 11,1 gam
= 0,1 * 18 = 1,8 gam
Bước 5: Giải phương trình, ta được:
= 10 + 7,3 – 11,1 – 1,8 = 4,4 gam
Vậy khối lượng khí
thoát ra là 4,4 gam.
Dạng 2: Xác định thành phần hỗn hợp
Ví dụ:
Cho 10 gam hỗn hợp gồm Mg và Al tác dụng với dung dịch HCl dư, thu được 11,2 lít khí
(đktc). Xác định thành phần % khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Lời giải:
Bước 1: Viết phương trình phản ứng:
Mg + 2HCl —>
+
2Al + 6HCl —> 2
+ 3
Bước 2: Áp dụng định luật bảo toàn khối lượng, ta có:
Bước 3: Ta biết:
= 0,5 mol
= 0,5 * 95 = 47,5 gam
= 0,25 * 133,5 = 33,375 gam
Bước 4: Thay số vào phương trình, ta có:
10 +
= 47,5 + 33,375 + 0,5 * 2
Bước 5: Giải phương trình, ta được:
= 10,625 gam
Bước 6: Gọi số mol Mg và Al trong hỗn hợp ban đầu là x và y.
= x + 1,5y = 0,5
= 24x
= 27y
Bước 7: Thay số vào phương trình, ta có:
24x + 27y = 10
x + 1,5y = 0,5
Bước 8: Giải hệ phương trình, ta được:
x = 0,2
y = 0,1
Bước 9: Tính thành phần % khối lượng của mỗi kim loại:
%Mg =
= 48%
%Al =
= 27%
Vậy thành phần % khối lượng của Mg và Al trong hỗn hợp ban đầu là 48% và 27%.
Dạng 3: Xác định chất dư
Ví dụ:
Cho 10 gam hỗn hợp gồm
và
tác dụng với dung dịch HCl dư, thu được 4,48 lít khí
(đktc). Xác định thành phần % khối lượng của mỗi muối trong hỗn hợp ban đầu.
Lời giải:
Bước 1: Viết phương trình phản ứng:
Bước 2: Áp dụng định luật bảo toàn khối lượng, ta có:
Bước 3: Ta biết:
= 0,2 mol
= 0,2 * 111 = 22,2 gam
= 0,2 * 95 = 19 gam
Bước 4: Thay số vào phương trình, ta có:
10 +
= 22,2 + 19 + 0,2 * 18 + 0,2 * 44
Bước 5: Giải phương trình, ta được:
= 15,6 gam
Bước 6: Gọi số mol
và
trong hỗn hợp ban đầu là x và y.
= x + y = 0,2
= 100x
= 84y
Bước 7: Thay số vào phương trình, ta có:
100x + 84y = 10
x + y = 0,2
Bước 8: Giải hệ phương trình, ta được:
x = 0,1
y = 0,1
Bước 9: Tính thành phần % khối lượng của mỗi muối:
%
= (0,1 * 100) / 10 * 100% = 50%
%
= (0,1 * 84) / 10 * 100% = 50%
Vậy thành phần % khối lượng của
và
trong hỗn hợp ban đầu là 50% và 50%.
Định luật này đã đóng vai trò quan trọng trong việc hiểu và mô tả các phản ứng hóa học, cung cấp một cơ sở vững chắc cho các nguyên tắc và quy tắc khác được áp dụng trong lĩnh vực này. Trên đây là những kiến thức cơ bản và chặt chẽ nhất mà yeuhoahoc.edu.vn đã chắt lọc ra cho các bạn. Chúc các bạn học tập tốt môn hoá nhé!







