Cân bằng ion
Hãy khám phá cùng chúng tôi về cân bằng ion: khái niệm, cách cân bằng và bài tập áp dụng qua nội dung chi tiết bài viết dưới đây
Cân bằng ion trong dung dịch là một trong những yếu tố cốt lõi ảnh hưởng đến tính chất của nhiều hệ thống hóa học và sinh học. Sự hiểu biết về cân bằng này giúp chúng ta kiểm soát và tối ưu hóa các phản ứng hóa học trong nhiều ứng dụng từ công nghiệp đến y tế. Hãy khám phá cùng chúng tôi qua bài viết dưới đây
Cân bằng ion là gì?
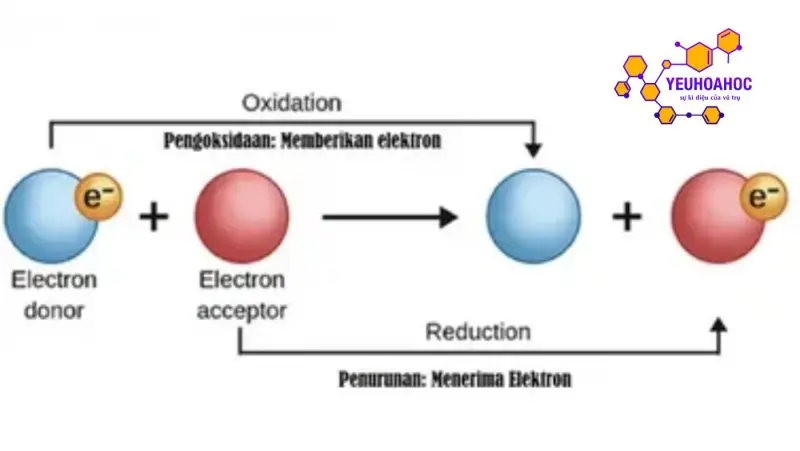
Cân bằng ion là một khái niệm quan trọng trong hóa học, đóng vai trò thiết yếu trong việc giải thích các hiện tượng hóa học xảy ra trong dung dịch điện li. Nó được định nghĩa như trạng thái cân bằng giữa các ion trong dung dịch, khi đó tốc độ điện li của các chất tan bằng tốc độ tái hợp của các ion.
Vai trò quan trọng của cân bằng ion trong hóa học:
- Giải thích các hiện tượng hóa học xảy ra trong dung dịch điện li: Cân bằng ion giúp giải thích các hiện tượng như: sự tan của các chất điện li, sự phân li axit – bazơ, phản ứng axit – bazơ, phản ứng oxi hóa – khử,…
- Ứng dụng trong nhiều lĩnh vực: Cân bằng ion có nhiều ứng dụng quan trọng trong thực tiễn như:
- Sản xuất hóa chất: Cân bằng ion được sử dụng để điều chỉnh điều kiện trong các quá trình sản xuất hóa chất, ví dụ như sản xuất axit, bazơ, muối,…
- Xử lý nước thải: Cân bằng ion được sử dụng để loại bỏ các ion kim loại nặng và các chất ô nhiễm khác khỏi nước thải.
- Sinh học: Cân bằng ion đóng vai trò quan trọng trong các quá trình sinh học như: hô hấp tế bào, quang hợp, truyền tín hiệu thần kinh,…
- Y học: Cân bằng ion là yếu tố quan trọng để duy trì sức khỏe con người. Sự rối loạn cân bằng ion có thể dẫn đến nhiều bệnh lý nguy hiểm.
Lý thuyết cân bằng ion
Khái niệm tích ion (Ka, Kb)
Tích ion là một khái niệm quan trọng trong lý thuyết cân bằng ion, được sử dụng để đo lường khả năng điện li của axit và bazơ trong dung dịch nước.
- Định nghĩa:
- Tích ion axit (Ka) là hằng số cân bằng cho phản ứng điện li của axit HA trong nước:
Giá trị Ka càng lớn, axit càng điện li mạnh, pH dung dịch càng thấp.
- Tích ion bazơ (Kb) là hằng số cân bằng cho phản ứng điện li của bazơ BOH trong nước:
Giá trị Kb càng lớn, bazơ càng điện li mạnh, pH dung dịch càng cao.
- Mối quan hệ giữa Ka và Kb:
Tích số ion của nước (Kw) là hằng số cân bằng cho phản ứng tự điện li của nước:
\[
\text{H}_2\text{O} \rightleftharpoons \text{H}_3\text{O}^+ + \text{OH}^-
\]
\[
K_w = [\text{H}_3\text{O}^+] [\text{OH}^-] = 10^{-14} \quad \text{(ở 25°C)}
\]
\[
\text{Mối quan hệ giữa } K_a \text{ và } K_b \text{ được biểu thị bởi công thức:}
\]
\[
K_a \cdot K_b = K_w = 10^{-14}
\]
- Ứng dụng:
- Dự đoán độ mạnh yếu của axit và bazơ: Dựa vào giá trị Ka và Kb, ta có thể so sánh độ mạnh yếu của các axit và bazơ khác nhau. Axit có Ka lớn hơn sẽ mạnh hơn axit có Ka nhỏ hơn. Bazơ có Kb lớn hơn sẽ mạnh hơn bazơ có Kb nhỏ hơn.
- Tính pH của dung dịch axit và bazơ: Sử dụng Ka và Kb, ta có thể tính pH của dung dịch axit và bazơ yếu, cũng như dự đoán sự thay đổi pH khi thêm axit hoặc bazơ vào dung dịch.
- Giải quyết các bài toán cân bằng ion trong dung dịch: Ka và Kb đóng vai trò quan trọng trong việc giải quyết các bài toán cân bằng ion trong dung dịch, bao gồm tính toán nồng độ các ion, pH dung dịch và xác định vị trí cân bằng của phản ứng.
Ví dụ:
Axit axetic \(\text{CH}_3\text{COOH}\) có \(K_a = 1.75 \times 10^{-5}\). Do \(K_a\) nhỏ, \(\text{CH}_3\text{COOH}\) là axit yếu.
Bazơ amoniac \(\text{NH}_3\) có \(K_b = 1.8 \times 10^{-5}\). Do \(K_b\) nhỏ, \(\text{NH}_3\) là bazơ yếu.
Tính pH của dung dịch \(\text{CH}_3\text{COOH}\) 0,01M.
Giải
\[
[\text{CH}_3\text{COOH}] = 0.01 \, \text{M}
\]
\[
[\text{H}_3\text{O}^+] = \sqrt{K_a \times [\text{CH}_3\text{COOH}]} = \sqrt{1.75 \times 10^{-5} \times 0.01} = 1.33 \times 10^{-4} \, \text{M}
\]
\[
\text{pH} = -\log[\text{H}_3\text{O}^+] = -\log(1.33 \times 10^{-4}) = 3.88
\]
\text{Vậy, pH của dung dịch CH}_3\text{COOH 0,01M là 3.88.}
Mối quan hệ giữa pH và tích ion (Ka, Kb)
- Công thức:
- Đối với axit:
Giải thích:
- -log[H+]: Là giá trị pH của dung dịch.
- logKa: Là logarit của tích ion axit (Ka).
- log[A-]: Là logarit của nồng độ ion axit (A-).
Công thức này cho thấy mối quan hệ logarit giữa pH, Ka và nồng độ ion axit. Giá trị Ka càng lớn, axit càng mạnh, pH dung dịch càng thấp. Ngược lại, axit có Ka nhỏ, pH dung dịch càng cao. Nồng độ ion axit (A-) cũng ảnh hưởng đến pH: nồng độ ion axit càng cao, pH càng thấp.
- Đối với bazơ:
Giải thích:
- 14: Là giá trị pH của dung dịch trung tính.
- -log[OH-]: Là logarit của nồng độ ion hydroxit (OH-).
- -logKb: Là logarit nghịch của tích ion bazơ (Kb).
- -log[B+]: Là logarit nghịch của nồng độ ion bazơ (B+).
Công thức này cho thấy mối quan hệ logarit giữa pH, Kb và nồng độ ion bazơ. Giá trị Kb càng lớn, bazơ càng mạnh, pH dung dịch càng cao. Ngược lại, bazơ có Kb nhỏ, pH dung dịch càng thấp. Nồng độ ion bazơ (B+) cũng ảnh hưởng đến pH: nồng độ ion bazơ càng cao, pH càng cao.
- Ứng dụng:
- Tính pH của dung dịch axit và bazơ: Sử dụng các công thức trên, ta có thể tính pH của dung dịch axit và bazơ yếu, cũng như dự đoán sự thay đổi pH khi thêm axit hoặc bazơ vào dung dịch.
- Phân tích dữ liệu thí nghiệm: Các công thức này được sử dụng để phân tích dữ liệu thu được từ các thí nghiệm đo pH của dung dịch axit và bazơ, từ đó xác định giá trị Ka và Kb của các chất.
- Nghiên cứu hóa học: Mối quan hệ giữa pH và tích ion đóng vai trò quan trọng trong nhiều lĩnh vực nghiên cứu hóa học, bao gồm hóa học phân tích, hóa học môi trường và hóa sinh.
Ví dụ:
Quy tắc chung để viết phương trình điện li
- Phân loại chất điện ly:
- Chất điện ly mạnh: Điện li hoàn toàn trong dung dịch, tức là hầu hết các phân tử tan trong nước đều phân li thành ion. Ví dụ: HCl, NaOH, H2SO4, KOH, Ba(OH)2, …
- Chất điện ly yếu: Điện li một phần trong dung dịch, tức là chỉ có một số phân tử tan trong nước bị phân li thành ion, phần còn lại tồn tại dưới dạng phân tử. Ví dụ: CH3COOH (axit axetic), H2CO3 (axit cacbonic), NH3 (amoniac), H2S (axit sunfuric), …
- Quy tắc viết phương trình điện li:
Đối với chất điện li mạnh:
- Viết công thức hóa học của chất điện ly.
- Viết các ion tạo thành sau khi điện li, sử dụng ký hiệu hóa học và số điện tích của các ion.
- Sử dụng mũi tên một chiều (→) để chỉ sự điện li hoàn toàn.
- Ghi tỷ lệ số lượng các ion theo hệ số cân bằng.
Ví dụ:
Đối với chất điện li yếu:
- Viết công thức hóa học của chất điện ly.
- Viết các ion tạo thành sau khi điện li, sử dụng ký hiệu hóa học và số điện tích của các ion.
- Sử dụng mũi tên hai chiều (⇌) để chỉ sự điện li không hoàn toàn.
- Ghi tỷ lệ số lượng các ion theo hệ số cân bằng.
Ví dụ:
Lưu ý:
- Khi viết phương trình điện li, cần đảm bảo rằng phương trình cân bằng về điện tích và số nguyên tử của mỗi nguyên tố.
- Đối với các axit đa chức, cần chú ý đến số lượng ion H+ được giải phóng.
- Một số ion có thể tồn tại dưới dạng nhiều dạng khác nhau trong dung dịch, cần xác định dạng ion chính xác dựa vào điều kiện pH của dung dịch.
Ví dụ:
Phương pháp cân bằng ion
Cân bằng ion là một kỹ thuật quan trọng trong hóa học để xác định lượng ion trong dung dịch sau khi xảy ra phản ứng hóa học. Có hai phương pháp chính để cân bằng ion:
- Phương pháp phương trình hóa học:
Bước 1: Viết phương trình hóa học của phản ứng điện li cho tất cả các chất điện ly trong dung dịch.
Bước 2: Cân bằng phương trình hóa học theo tỷ lệ mol của các chất tham gia phản ứng.
Bước 3: Thay thế nồng độ mol của các chất tham gia phản ứng bằng biểu thức biểu thị nồng độ ion tương ứng.
Bước 4: Viết các phương trình biểu thị mối quan hệ giữa nồng độ ion và hằng số cân bằng (Ka, Kb, Kw).
Bước 5: Giải hệ phương trình thu được để tìm nồng độ ion của các ion trong dung dịch.
Ưu điểm:
- Phương pháp này trực quan và dễ hiểu.
- Có thể áp dụng cho nhiều loại phản ứng hóa học khác nhau.
Nhược điểm:
- Có thể phức tạp khi giải hệ phương trình cho các phản ứng có nhiều ion tham gia.
- Không áp dụng được cho các dung dịch có nồng độ ion thấp.
Ví dụ:
Cân bằng ion cho phản ứng trung hòa axit-bazơ giữa axit axetic (CH3COOH) và natri hydroxit (NaOH):
Bước 1:
\[
\text{CH}_3\text{COOH} + \text{NaOH} \rightleftharpoons \text{CH}_3\text{COONa} + \text{H}_2\text{O}
\]
Bước 2:
\[
1 \text{ CH}_3\text{COOH} + 1 \text{ NaOH} \rightleftharpoons 1 \text{ CH}_3\text{COONa} + 1 \text{ H}_2\text{O}
\]
Bước 3:
\[
[\text{CH}_3\text{COOH}] = [\text{CH}_3\text{COONa}] = x \text{ M} \quad [\text{NaOH}] = y \text{ M} \quad [\text{H}^+] = K_a \times \frac{[\text{CH}_3\text{COOH}]}{[\text{CH}_3\text{COONa}]} \quad [\text{OH}^-] = \frac{1}{[\text{H}^+]} = \frac{[\text{CH}_3\text{COONa}]}{(K_a \times [\text{CH}_3\text{COOH}])}
\]
Bước 4:
\[
K_w = [\text{H}^+] [\text{OH}^-] = 10^{-14}
\]
Bước 5:
- Phương pháp tích ion:
Bước 1: Viết phương trình biểu thị tích ion cho các chất điện ly trong dung dịch.
Bước 2: Thay thế nồng độ mol của các chất tham gia phản ứng bằng biểu thức biểu thị nồng độ ion tương ứng.
Bước 3: Viết phương trình biểu thị mối quan hệ giữa nồng độ ion và hằng số cân bằng (Ka, Kb, Kw).
Bước 4: Giải hệ phương trình thu được để tìm nồng độ ion của các ion trong dung dịch.
Ưu điểm:
- Phương pháp này đơn giản và nhanh chóng.
- Có thể áp dụng cho các dung dịch có nồng độ ion thấp.
Nhược điểm:
- Không trực quan và khó hiểu bằng phương pháp phương trình hóa học.
- Chỉ áp dụng được cho các phản ứng có một số ion tham gia.
Ví dụ:
Bước 1
\[
K_a = \frac{[\text{H}^+][\text{CH}_3\text{COO}^-]}{[\text{CH}_3\text{COOH}]}
\]
Bước 2
\[
[\text{H}^+] = x \, \text{M} \quad [\text{CH}_3\text{COO}^-] = x \, \text{M} \quad [\text{CH}_3\text{COOH}] = y \, \text{M}
\]
Bước 3
\[
K_a = \frac{x^2}{y}
\]
Bước 4
Giải phương trình cho x và y ta thu được:
\[
x = [\text{H}^+] = \sqrt{K_a \cdot y} \quad y = [\text{CH}_3\text{COOH}] = \frac{K_a}{x^2}
\]
Hệ số pH: Thể hiện mức độ axit, bazơ của dung dịch.
Hệ số pH là một đại lượng hóa học quan trọng được sử dụng để đo mức độ axit hoặc bazơ của dung dịch. Nó được định nghĩa là logarit âm của nồng độ ion hydro (H+) trong dung dịch.
Ký hiệu: pH
Công thức: pH = -log[H+]
Thang đo pH:
- 0 < pH < 7: Dung dịch mang tính axit.
- pH = 7: Dung dịch trung tính.
- 7 < pH < 14: Dung dịch mang tính bazơ.
Ý nghĩa:
- pH thấp (pH < 4): Dung dịch có tính axit mạnh, có khả năng ăn mòn cao.
- pH trung bình (4 ≤ pH ≤ 6): Dung dịch có tính axit yếu hoặc hơi axit.
- pH gần 7 (6,5 ≤ pH ≤ 7,5): Dung dịch gần như trung tính.
- pH cao (pH > 8): Dung dịch có tính bazơ mạnh, có khả năng xà phòng hóa cao.
Phương trình Henderson-Hasselbalch
Phương trình Henderson-Hasselbalch là một công thức toán học quan trọng trong hóa học được sử dụng để mô tả mối quan hệ giữa pH, pKa, nồng độ axit (HA) và nồng độ muối axit (A-) trong dung dịch.
Công thức:
Giải thích:
- pH: Hệ số pH của dung dịch.
- pKa: Logarit âm của hằng số điện li axit (Ka).
- [A-]: Nồng độ mol của ion axit (A-).
- [HA]: Nồng độ mol của axit (HA).
Ý nghĩa:
- Phương trình cho thấy mối quan hệ logarit giữa pH, pKa và tỷ lệ nồng độ ion axit (A-) so với nồng độ axit (HA).
- Giá trị pKa càng nhỏ, axit càng mạnh, pH dung dịch càng thấp. Ngược lại, axit có pKa lớn, pH dung dịch càng cao.
- Tỷ lệ nồng độ ion axit (A-) so với nồng độ axit (HA) cũng ảnh hưởng đến pH: tỷ lệ này càng cao, pH càng thấp.
Ứng dụng:
- Dự đoán pH của dung dịch axit yếu: Sử dụng công thức Henderson-Hasselbalch, ta có thể dự đoán pH của dung dịch axit yếu dựa vào giá trị pKa và tỷ lệ nồng độ ion axit (A-) so với nồng độ axit (HA).
- Điều chỉnh độ pH của dung dịch: Sử dụng công thức Henderson-Hasselbalch, ta có thể điều chỉnh độ pH của dung dịch axit yếu bằng cách thay đổi tỷ lệ nồng độ ion axit (A-) so với nồng độ axit (HA).
- Nghiên cứu sinh học và hóa sinh: Phương trình Henderson-Hasselbalch đóng vai trò quan trọng trong việc nghiên cứu sự cân bằng axit-bazơ trong cơ thể sinh vật và trong các phản ứng hóa học sinh học.
Ví dụ:
- Tính pH của dung dịch CH3COOH 0,01M (pKa = 4,75) với tỷ lệ nồng độ ion axit (A-) so với nồng độ axit (HA) là 1:1.
Giải:
Vậy, pH của dung dịch CH3COOH 0,01M với tỷ lệ nồng độ ion axit (A-) so với nồng độ axit (HA) là 1:1 là 4,75.
Ví dụ ứng dụng của cân bằng ion
Xác định độ pH của dung dịch axit, bazơ, muối
- Axit: Sử dụng phương trình điện li và hằng số điện li axit (Ka) để tính nồng độ ion H+ trong dung dịch, từ đó xác định pH.
- Bazơ: Sử dụng phương trình điện li và hằng số điện li bazơ (Kb) để tính nồng độ ion OH- trong dung dịch, từ đó xác định pH.
- Muối: Muối là sản phẩm của phản ứng trung hòa axit-bazơ, pH của dung dịch muối phụ thuộc vào tính axit/bazơ của axit và bazơ tạo thành muối.
Ví dụ: Xác định pH của dung dịch CH3COOH 0,01M (Ka = 1,75 x 10^-5).
Lời giải:
- Viết phương trình điện li của CH3COOH: CH3COOH ⇌ H+ + CH3COO-
- Tính nồng độ ion H+: [H+] = √(Ka * [CH3COOH]) = √(1,75 x 10^-5 * 0,01) = 1,33 x 10^-4 M
- Tính pH: pH = -log[H+] = -log(1,33 x 10^-4) = 3,88
Vậy, pH của dung dịch CH3COOH 0,01M là 3,88.
Tính toán nồng độ các ion trong dung dịch điện li
- Sử dụng phương trình điện li và hằng số cân bằng (Ka, Kb, Kw) để thiết lập các phương trình liên quan đến nồng độ các ion.
- Giải hệ phương trình thu được để tìm nồng độ mong muốn.
Ví dụ: Tính nồng độ ion H+ và OH- trong dung dịch NH3 0,1M (Kb = 1,8 x 10^-5).
Lời giải:
- Viết phương trình điện li của NH3: NH3 + H2O ⇌ NH4+ + OH-
- Viết phương trình biểu thị mối quan hệ giữa nồng độ ion và hằng số cân bằng: Kb = [NH4+] [OH-] / [NH3]
- Viết phương trình biểu thị mối quan hệ giữa nồng độ ion H+ và OH-: Kw = [H+] [OH-] = 10^-14
- Giải hệ 3 phương trình với 3 ẩn số [NH4+], [OH-] và [H+] ta thu được:
- [NH4+] = 1,8 x 10^-6 M
- [OH-] = 1,8 x 10^-9 M
- [H+] = 5,56 x 10^-6 M
Vậy, nồng độ ion H+ trong dung dịch NH3 0,1M là 5,56 x 10^-6 M và nồng độ ion OH- là 1,8 x 10^-9 M.
Phân tích định lượng các chất trong dung dịch
- Sử dụng phương pháp kết tủa chọn lọc để tách riêng các ion trong dung dịch.
- Xác định nồng độ các ion bằng phương pháp so sánh màu, điện hóa hoặc sắc ký.
Ví dụ: Phân tích định lượng ion Cl- trong dung dịch NaCl bằng phương pháp kết tủa chọn lọc.
Giải pháp:
- Thêm dung dịch AgNO3 vào dung dịch NaCl, tạo ra kết tủa AgCl màu trắng.
- Lọc kết tủa, rửa sạch và sấy khô.
- Tính toán khối lượng NaCl dựa vào khối lượng kết tủa AgCl thu được.
Điều chỉnh độ pH trong các lĩnh vực
- Sản xuất thực phẩm: Điều chỉnh độ pH trong sản xuất thực phẩm để bảo quản thực phẩm, kiểm soát vi sinh và tạo hương vị mong muốn.
- Y học: Điều chỉnh độ pH trong dung dịch thuốc để đảm bảo hiệu quả và độ an toàn cho bệnh nhân.
- Xử lý nước thải: Điều chỉnh độ pH trong quá trình xử lý nước thải để loại bỏ các chất ô nhiễm và kim loại nặng.
Ví dụ: Sử dụng dung dịch NaOH để điều chỉnh độ pH của nước thải axit về mức trung tính.
Các dạng bài tập vận dụng cân bằng ion
Bài 1: Tính pH của dung dịch axit axetic (CH3COOH) 0,01M, biết Ka = 1,75.10^-5.
Giải:
Bước 1: Viết phương trình điện li của axit axetic:
CH3COOH ⇌ H+ + CH3COO-
Bước 2: Viết biểu thức biểu thị mối quan hệ giữa nồng độ ion và hằng số điện li axit (Ka):
Ka = [H+] [CH3COO-] / [CH3COOH]
Bước 3: Thay giá trị vào biểu thức:
1,75 x 10^-5 = [H+]^2 / [CH3COOH]
Bước 4: Giải phương trình:
[H+] = √(Ka * [CH3COOH]) = √(1,75 x 10^-5 * 0,01) = 1,33 x 10^-4 M
Bước 5: Tính pH:
pH = -log[H+] = -log(1,33 x 10^-4) = 3,88
Vậy, pH của dung dịch axit axetic (CH3COOH) 0,01M là 3,88.
Bài 2: Xác định độ tan của BaSO4 trong nước, biết tích số hòa tan của BaSO4 là Ksp = 1,1.10^-10.
Giải:
Bước 1: Viết phương trình điện li của BaSO4:
BaSO4 ⇌ Ba2+ + SO42-
Bước 2: Viết biểu thức biểu thị mối quan hệ giữa độ tan (S) và tích số hòa tan (Ksp):
Ksp = [Ba2+] [SO42-] = S^2
Bước 3: Thay giá trị vào biểu thức:
1,1 x 10^-10 = S^2
Bước 4: Giải phương trình:
S = √Ksp = √(1,1 x 10^-10) = 3,32 x 10^-6 M
Vậy, độ tan của BaSO4 trong nước là 3,32 x 10^-6 M.
Bài 3: Tính pH của dung dịch hỗn hợp gồm NaOH 0,01M và HCl 0,005M.
Bước 1: Viết phương trình của phản ứng trung hòa
NaOH + HCl ⇌ NaCl + H2O
Bước 2: Xác định lượng ion H+ dư thừa:
[H+] dư = [HCl] – [NaOH] = 0,005M – 0,01M = -0,005M
Lưu ý: Giá trị âm cho thấy lượng ion OH- dư thừa.
Bước 3: Tính nồng độ ion OH- dư thừa:
[OH-] dư = -[H+] dư = 0,005M
Bước 4: Tính pOH:
pOH = -log[OH-] = -log(0,005) = 2,30
Bước 5: Tính pH:
pH + pOH = 14
pH = 14 – pOH = 14 – 2,30 = 11,70
Vậy, pH của dung dịch hỗn hợp là 11,70.
Lưu ý: Do lượng ion OH- dư thừa, dung dịch có tính bazơ.
“Nghiên cứu và áp dụng kiến thức về cân bằng ion không chỉ giúp nâng cao nhận thức khoa học mà còn cải tiến các công nghệ xử lý và làm sạch môi trường. Những phát triển mới trong lĩnh vực này hứa hẹn sẽ mang lại các giải pháp hiệu quả hơn cho các thách thức toàn cầu trong tương lai.”







