Benzen
Bài viết này, chúng tôi sẽ cung cấp thông tin chi tiết về benzen, bao gồm tính chất, ứng dụng và tác động môi trường của nó.
Benzen, một hợp chất hữu cơ thơm đơn giản với công thức C6H6, đóng vai trò quan trọng trong sản xuất hóa chất, dung môi và nhiên liệu. Bài viết này, chúng tôi sẽ cung cấp thông tin chi tiết về benzen, bao gồm tính chất, ứng dụng và tác động môi trường của nó.
Khái niệm về benzen
Định nghĩa:
- Benzen là một hợp chất hữu cơ thuộc nhóm hydrocarbon thơm, có công thức phân tử C6H6.
- Benzen là chất lỏng không màu, có mùi thơm đặc trưng, dễ cháy và tan kém trong nước.
- Benzen còn được gọi với các tên khác như: phenyl, benzol, benzen.
Đặc điểm cấu tạo:
- Vòng benzen: Benzen có cấu trúc đặc trưng bởi vòng sáu nguyên tử cacbon liên kết với nhau bằng liên kết σ và π xen kẽ, tạo thành cấu trúc vòng thơm.
- Liên kết pi: Liên kết π trong vòng benzen được delocal hóa, tức là được chia sẻ đều giữa các nguyên tử cacbon trong vòng.
- Tính thơm: Do cấu trúc vòng benzen đặc trưng và liên kết π delocalized, benzen có tính thơm với những đặc điểm:
- Dễ dàng tham gia vào phản ứng thế hơn phản ứng cộng.
- Phản ứng thế xảy ra chủ yếu ở vị trí meta (m).
- Benzen bền với tác nhân oxi hóa.
So sánh benzen với các hợp chất hữu cơ khác:
| Đặc điểm | Benzen | Alkan | Anken | Ankin |
| Công thức phân tử | CnH2n-6 (n ≥ 6) | CnH2n+2 | CnH2n | CnH2n-2 |
| Cấu tạo | Vòng benzen | Mạch hở | Mạch hở | Mạch hở |
| Liên kết | σ và π delocalized | σ | σ và π | σ và 3π |
| Tính chất | Tính thơm, dễ thế, khó cộng | Bền, khó tham gia phản ứng | Dễ cộng, khó thế | Dễ cộng, dễ thế |
| Ví dụ | Benzen, toluen, xilen | Metan, etan, propan | Etilen, propen | Axetilen, but-2-in |
Tính chất của benzen
Tính chất vật lý của Benzen
Benzen (C6H6) là một chất lỏng không màu, có mùi thơm đặc trưng, dễ cháy và tan kém trong nước. Dưới đây là một số tính chất vật lý quan trọng của benzen:
Trạng thái: Chất lỏng Màu sắc: Không màu Mùi: Mùi thơm đặc trưng Điểm nóng chảy: 5,5 °C Điểm sôi: 80,1 °C Khối lượng riêng: 0,879 g/cm³ (ở 20 °C) Độ tan: * Ít tan trong nước * Tan dễ trong các dung môi hữu cơ như: etanol, ether, axeton,…Độ nhớt: 0,804 mPa·s (ở 20 °C) Chỉ số khúc xạ: 1,5014 (ở 20 °C) Áp suất hơi: 101,3 kPa (ở 20 °C) Nhiệt độ bốc cháy: -11 °C Nhiệt độ tự bốc cháy: 537 °C Giới hạn nổ: * Giới hạn dưới: 1,5% * Giới hạn trên: 7,8%
Ngoài ra, benzen còn có một số tính chất vật lý khác:
- Benzen có thể hòa tan một số chất như: dầu, mỡ, cao su,…
- Benzen là chất cách điện tốt.
- Benzen dễ bay hơi, tạo thành hơi độc hại.
Tính chất hóa học của Benzen
Benzen (C6H6) là một hợp chất hữu cơ thơm có cấu trúc vòng benzen đặc trưng và tính thơm. Do cấu trúc đặc biệt này, benzen có những tính chất hóa học khác biệt so với các hợp chất hữu cơ khác.
- Phản ứng thế:
Phản ứng thế benzen với halogen:
Benzen dễ tham gia phản ứng thế halogen hơn so với các ankan do ảnh hưởng của tính thơm. Phản ứng xảy ra theo cơ chế gọi là “cộng cộng-tách rời”.
Ví dụ:
Phản ứng thế benzen với axit nitric đậm đặc:
Benzen phản ứng với axit nitric đậm đặc trong điều kiện có xúc tác axit sunfuric đậm đặc để tạo thành nitrobenzen.
Ví dụ:
- Phản ứng cộng:
Phản ứng cộng hiđro:
Benzen khó tham gia phản ứng cộng hiđro do ảnh hưởng của tính thơm. Tuy nhiên, benzen có thể cộng hiđro trong điều kiện có xúc tác niken và nhiệt độ cao để tạo thành cyclohexan.
Ví dụ:
C6H6 + 3H2 (Ni, t°) → C6H12
Phản ứng cộng halogen:
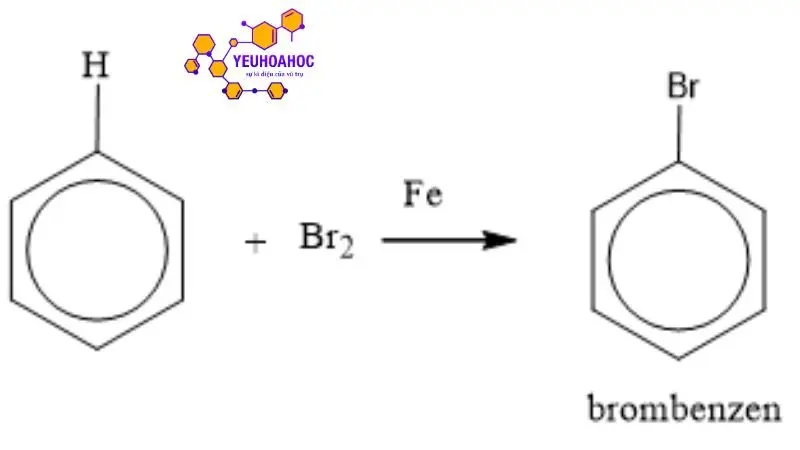
Benzen cũng có thể cộng halogen trong điều kiện có xúc tác bột sắt và ánh sáng để tạo thành dẫn xuất benzen halohydrin.
Ví dụ:
C6H6 + Br2 (Fe, ánh sáng) → C6H5Br + HBr
- Phản ứng oxi hóa:
Benzen tương đối bền với các tác nhân oxi hóa thông thường. Tuy nhiên, benzen có thể bị oxi hóa mạnh bằng kali pemanganat trong môi trường kiềm để tạo thành benzenxơ (C6H6O).
Ví dụ:
2C6H6 + 3KMnO4 + 2KOH → 2C6H6O + 3K2MnO2 + 2H2O
Lưu ý:
- Benzen là chất độc hại, cần lưu ý an toàn khi sử dụng.
- Benzen dễ cháy nổ, cần tránh xa nguồn nhiệt và lửa.
Phương pháp điều chế benzen
Benzen (C6H6) là một hợp chất hữu cơ quan trọng được sử dụng rộng rãi trong công nghiệp hóa chất. Có hai phương pháp chính để điều chế benzen:
Trong phòng thí nghiệm
Từ axetilen:
Đây là phương pháp phổ biến trong phòng thí nghiệm để điều chế benzen. Axetilen được đun nóng ở nhiệt độ cao (khoảng 600°C) với chất xúc tác là đất sét hoạt tính hoặc than hoạt tính. Phản ứng xảy ra theo cơ chế trimer hóa.
Ví dụ:
3C2H2 (t°, xúc tác) → C6H6
Từ xiclohexan:
Xiclohexan được khử hydro hóa bằng xúc tác niken ở nhiệt độ cao (khoảng 300°C) để tạo thành benzen.
Ví dụ:
C6H12 (Ni, t°) → C6H6 + 3H2
Từ benzenxơ:
Benzenxơ (C6H6O) được khử bằng hydro trong điều kiện có xúc tác niken hoặc palladium để tạo thành benzen.
Ví dụ:
C6H6O (Ni/Pd, H2) → C6H6 + H2O
Điều chế benzen trong công nghiệp
Từ nguồn gốc hóa thạch:
- Chưng cất nhựa than đá: Đây là phương pháp truyền thống để điều chế benzen, chiếm khoảng 50% sản lượng benzen toàn cầu. Nhựa than đá được nung nóng trong điều kiện thiếu oxy, tạo ra hỗn hợp khí gọi là khí than đá. Hỗn hợp này được tách chiết để thu hồi benzen.
- Cải tạo xăng: Quá trình cải tạo xăng (reforming) biến đổi cấu trúc phân tử của các ankan mạch thẳng thành benzen và các hợp chất thơm khác. Phương pháp này chiếm khoảng 30% sản lượng benzen toàn cầu.
Từ nguồn gốc phi hóa thạch:
- Tách benzen từ dầu mỏ: Một số loại dầu mỏ có chứa benzen tự nhiên. Benzen được tách ra khỏi dầu mỏ bằng quá trình chưng cất và xử lý hóa học.
- Tổng hợp từ etylen: Etilen có thể được chuyển hóa thành benzen thông qua quá trình oligomer hóa và cyclization xúc tác axit. Phương pháp này đang được phát triển và có tiềm năng trở thành nguồn cung cấp benzen quan trọng trong tương lai.
Lựa chọn phương pháp điều chế benzen phụ thuộc vào nhiều yếu tố, bao gồm:
- Nguồn nguyên liệu sẵn có
- Giá thành sản xuất
- Hiệu quả chuyển hóa
- Tác động môi trường
Ngoài ra, một số phương pháp điều chế benzen ít phổ biến hơn bao gồm:
- Từ axit benzoic: Axit benzoic được khử bằng hydro hóa xúc tác để tạo thành benzen.
- Từ axetilen: Ba phân tử axetilen có thể kết hợp với nhau để tạo thành benzen trong điều kiện xúc tác.
Ứng dụng của Benzen
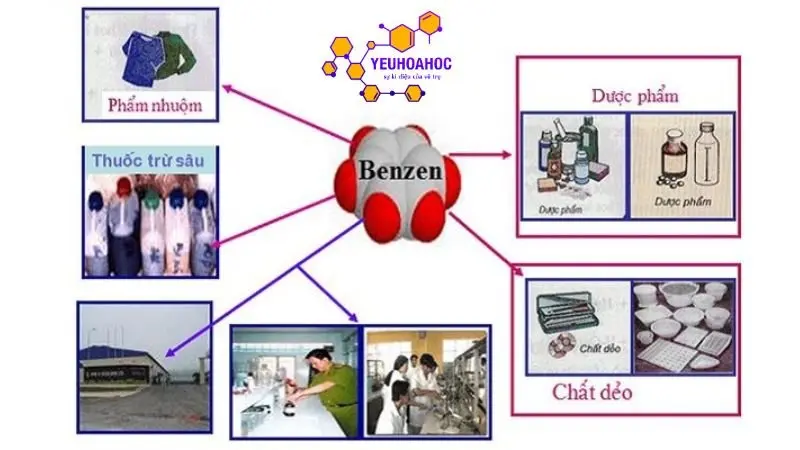
Trong sản xuất hóa chất:
- Sản xuất xăng, dầu hỏa: Benzen là một thành phần quan trọng trong xăng và dầu hỏa, giúp tăng chỉ số octan và cải thiện hiệu suất động cơ.
- Sản xuất nhựa, cao su: Benzen được sử dụng để sản xuất monome, là nguyên liệu đầu vào cho sản xuất các loại nhựa như polystyrene, ABS,… và cao su tổng hợp như styrene-butadiene rubber (SBR).
- Sản xuất thuốc nhuộm: Benzen là nguyên liệu đầu vào cho sản xuất nhiều loại thuốc nhuộm quan trọng, được sử dụng trong ngành dệt may, da,…
- Sản xuất thuốc nổ: Benzen được sử dụng để sản xuất TNT (trinitrotoluen), một loại thuốc nổ mạnh được sử dụng trong quân sự và khai thác mỏ.
Trong sản xuất dược phẩm:
- Sản xuất aspirin: Benzen được sử dụng để sản xuất aspirin, một loại thuốc giảm đau, hạ sốt và chống viêm.
- Sản xuất paracetamol: Benzen cũng được sử dụng để sản xuất paracetamol, một loại thuốc giảm đau, hạ sốt phổ biến.
- Sản xuất vitamin C: Benzen được sử dụng để sản xuất vitamin C, một loại vitamin quan trọng cho sức khỏe con người.
Trong sản xuất dung môi:
- Xăng: Benzen là một thành phần của xăng, được sử dụng để hòa tan các thành phần khác của xăng và giúp vận chuyển nhiên liệu qua động cơ.
- Ete: Benzen được sử dụng để sản xuất ete, một loại dung môi hữu cơ phổ biến được sử dụng trong nhiều ngành công nghiệp.
- Axeton: Benzen cũng được sử dụng để sản xuất axeton, một loại dung môi hữu cơ khác được sử dụng trong nhiều ứng dụng như tẩy sơn móng tay, pha loãng sơn,..
Tác hại của Benzen và biện pháp bảo Vệ
Tác hại của Benzen
Benzen (C6H6) là một hợp chất hữu cơ độc hại có thể gây ra nhiều ảnh hưởng nghiêm trọng đến sức khỏe con người và môi trường.
Ảnh hưởng đến sức khỏe:
- Gây ung thư: Benzen được Cơ quan Nghiên cứu Quốc tế về Phòng chống Ung thư (IARC) xếp loại là chất gây ung thư ở người (nhóm 1). Tiếp xúc với benzen trong thời gian dài có thể làm tăng nguy cơ mắc các bệnh ung thư máu như bạch cầu cấp tính, u lympho, v.v.
- Ảnh hưởng đến hệ thần kinh: Benzen có thể gây ra các triệu chứng thần kinh như nhức đầu, chóng mặt, buồn nôn, nôn mửa, mất ý thức, thậm chí tử vong.
- Ảnh hưởng đến hệ hô hấp: Tiếp xúc với benzen có thể gây kích ứng đường hô hấp, ho, khó thở, viêm phổi, v.v.
- Gây ảnh hưởng đến thai nhi: Phụ nữ mang thai tiếp xúc với benzen có nguy cơ cao sinh con dị tật bẩm sinh.
Ảnh hưởng đến môi trường:
- Gây ô nhiễm không khí: Benzen được thải ra môi trường từ các hoạt động công nghiệp, giao thông vận tải và sinh hoạt. Benzen trong không khí có thể gây ra các vấn đề về hô hấp, tim mạch và ung thư.
- Gây ô nhiễm nước: Benzen có thể xâm nhập vào nguồn nước ngầm từ các hoạt động công nghiệp và nông nghiệp. Nước bị ô nhiễm benzen có thể gây ra các vấn đề sức khỏe nghiêm trọng cho con người.
- Gây ô nhiễm đất: Benzen có thể xâm nhập vào đất từ các hoạt động công nghiệp và nông nghiệp. Benzen trong đất có thể ảnh hưởng đến chất lượng cây trồng và gây hại cho các sinh vật sống trong đất.
Biện pháp bảo vệ con người và môi trường khỏi tác hại của Benzen
Sử dụng benzen an toàn trong sản xuất và sinh hoạt:
- Cần tuân thủ các quy định an toàn lao động khi sử dụng benzen trong sản xuất.
- Sử dụng các biện pháp bảo hộ cá nhân như khẩu trang, găng tay, kính bảo hộ khi tiếp xúc với benzen.
- Tránh sử dụng các sản phẩm có chứa benzen trong sinh hoạt nếu không cần thiết.
Xử lý nước thải và khí thải có chứa benzen:
- Cần xử lý nước thải và khí thải có chứa benzen trước khi thải ra môi trường.
- Có thể sử dụng các phương pháp xử lý như hấp phụ, khử trùng bằng ozon, v.v. để loại bỏ benzen khỏi nước thải và khí thải.
Tăng cường nhận thức về việc bảo vệ môi trường
- Cần nâng cao ý thức của cộng đồng về tác hại của benzen đối với sức khỏe con người và môi trường.
- Khuyến khích sử dụng các nguồn năng lượng tái tạo và các phương tiện giao thông thân thiện với môi trường để giảm thiểu lượng benzen thải ra môi trường.
- Tham gia các hoạt động bảo vệ môi trường để góp phần bảo vệ sức khỏe con người và môi trường khỏi tác hại của benzen.
Bài tập về benzen có lời giải chi tiết
Hiđrocacbon X là một chất lỏng và có tỉ khối hơi so với không khí bằng 6,34. Đốt cháy hoàn toàn hiđrocacbon X thu được CO2, có khối lượng bằng 4,28 lần khối lượng của nước. Ở nhiệt độ thường, X không gây mất màu dung dịch brom nhưng khi đun nóng (có xúc tác nhiệt độ), X làm mất màu dung dịch KMnO4
Lời giải
Bước 1: Xác định công thức phân tử của X
- Tính khối lượng mol của X: Tỉ khối hơi của X so với không khí là 6,34. Không khí có khối lượng mol trung bình là khoảng 29 g/mol.
\[
M_X = 6,34 \times 29 = 183,86 \text{ g/mol} \approx 184 \text{ g/mol}
\]
Phân tích sản phẩm đốt cháy: Khi đốt cháy X thu được CO2 và H2O sao cho khối lượng CO2 gấp 4,28 lần khối lượng H2O. Đặt số mol của X là 1 mol, ta có:
- Số mol CO2 = số mol C trong X
- Số mol H2O = số mol H trong X / 2
\[
\text{Số mol CO}_2 = \text{Số mol C trong X}
\]
\[
\text{Số mol H}_2\text{O} = \frac{\text{Số mol H trong X}}{2}
\]
\[
44 \times \text{Số mol CO}_2 = 4,28 \times 18 \times \text{Số mol H}_2\text{O}
\]
\[
\text{Số mol CO}_2 = 4,28 \times \text{Số mol H}_2\text{O}
\]
Giả sử X có \( n \) nguyên tử C và \( 2m \) nguyên tử H, ta có:
\[
n = 4,28m \quad \Rightarrow \quad m = \frac{n}{4,28}
\]
\[
12n + 2m = 184
\]
\[
12n + \frac{2n}{4,28} = 184
\]
Giải phương trình này, ta có thể ước tính được \( n \) và \( m \), từ đó xác định công thức phân tử của X.
Bước 2: Xác định công thức cấu tạo của X
- Tính chất hóa học của X:
- X không tác dụng với dung dịch brom ở nhiệt độ thường → X không có liên kết đôi C=C.
- X làm mất màu dung dịch KMnO4 khi đun nóng → X có liên kết ba C≡C hoặc nhóm chức khác có khả năng bị oxi hóa.
- Khả năng làm mất màu KMnO4 và không phản ứng với dung dịch brom chỉ ra rằng X có thể là một ankin.
Giả sử X là một ankin với công thức tổng quát là CnH2n-2, phù hợp với khối lượng mol đã tính. Dựa trên khối lượng mol ước tính, ta có thể đề xuất công thức cấu tạo cụ thể cho X, chẳng hạn như cyclooctyne nếu n = 8.
Bước 3: Viết các phản ứng hóa học
- Phản ứng với H2 (có Ni, đun nóng)
\[
\text{C}_n\text{H}_{2n-2} + \text{H}_2 \rightarrow \text{C}_n\text{H}_{2n}
\]
Phản ứng với Br2 (có bột Fe):
\[\text{C}_n\text{H}_{2n-2} + \text{Br}_2 \rightarrow \text{Br-C}_n\text{H}_{2n-2}\text{-Br}
\]
Phản ứng với hỗn hợp HNO3 và H2SO4:
\text{C}_n\text{H}_{2n-2} + \text{HNO}_3 \rightarrow \text{Nitro-C}_n\text{H}_{2n-3} + \text{H}_2\text{O}\]
Benzen, mặc dù mang lại nhiều lợi ích, cũng tiềm ẩn nguy cơ cho sức khỏe và môi trường. Sử dụng benzen một cách an toàn và có trách nhiệm là chìa khóa để đảm bảo sự phát triển bền vững.







