Bảng hoá trị hay nhất và những mẹo nhớ lâu nhất
Bài viết dưới đây đã tổng hợp lại đầy đủ, chi tiết nhất bảng hoá trị của các nguyên tố và hoá trị của một số nhóm nguyên tử cơ bản cùng với mẹo học thuộc chúng
Định nghĩa về hóa trị và bảng thống kê hóa trị các nguyên tố
Bảng hóa trị là một công cụ vô cùng quan trọng trong học tập hóa học. Nó giúp chúng ta xác định hóa trị của các nguyên tố trong các hợp chất, từ đó viết được công thức hóa học chính xác và cân bằng các phương trình hóa học. Trong bài dưới dưới đây yeuhoahoc.edu.vn đã tổng hợp lại đầy đủ và chi tiết nhất về hoá trị của các nguyên tố và hoá trị của một số nhóm nguyên tử cơ bản. Đồng thời, bài viết còn có những mẹo hay giúp học hoá trị của các nguyên tố nhanh nhất và nhớ lâu nhất
Định nghĩa về hóa trị
Hóa trị là khái niệm chỉ số liên kết hoặc khả năng kết hợp của một nguyên tố hóa học với nguyên tố khác để tạo thành hợp chất. Hóa trị phản ánh số lượng nguyên tử của một nguyên tố (thường là hydro hoặc oxy, trong hầu hết các trường hợp) mà một nguyên tử của nguyên tố đó có thể liên kết hoặc thay thế. Hóa trị giúp xác định tỷ lệ mà các nguyên tố kết hợp với nhau trong một hợp chất hóa học.
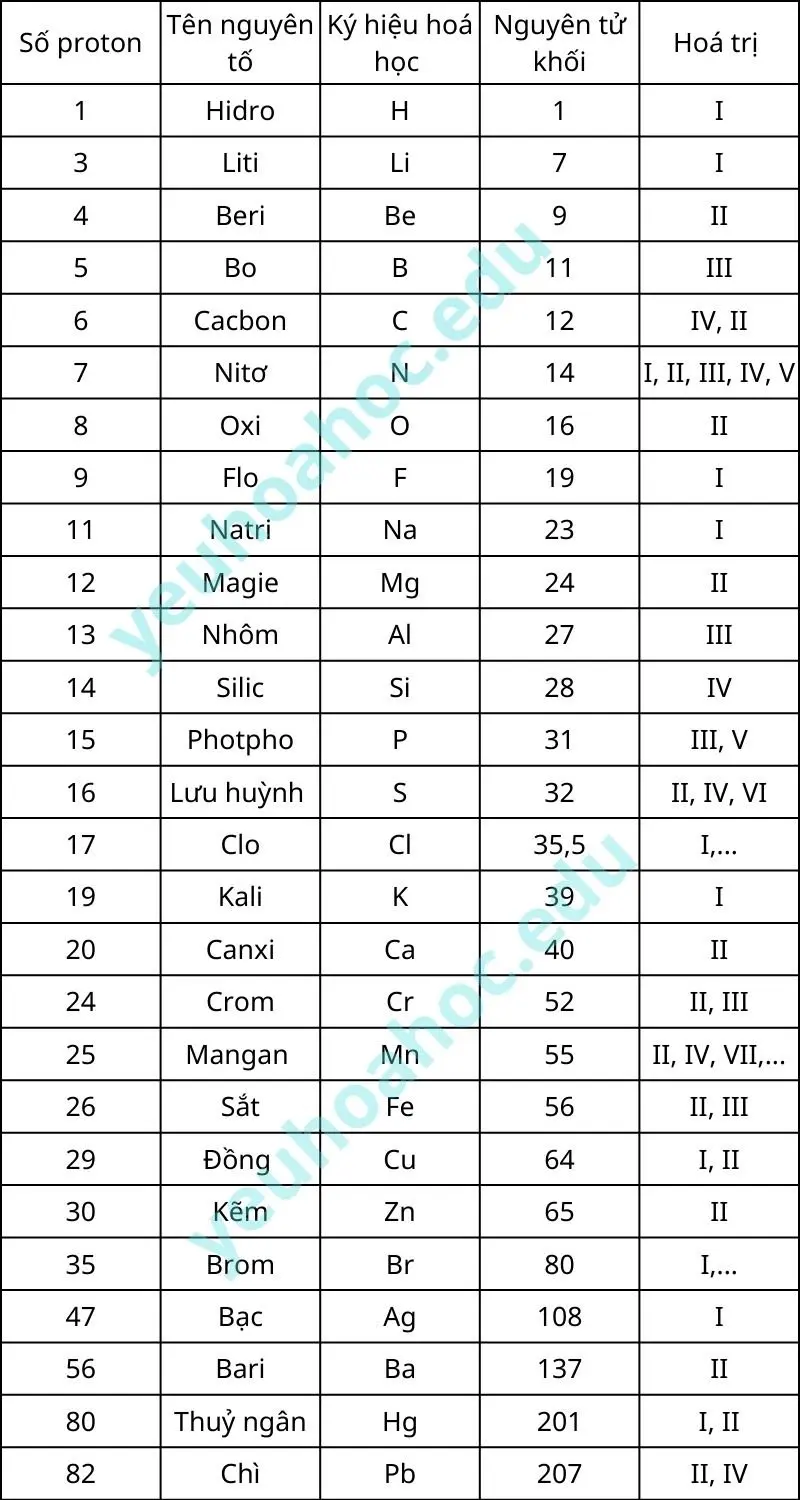
Bảng hóa trị: Cung cấp thông tin về các nguyên tố hóa học quan trọng và giá trị hóa trị của chúng. Để giải các bài tập hóa học cơ bản, sinh viên cần nắm vững bảng hóa trị.
Lưu ý rằng một số nguyên tố chỉ có một hóa trị cố định, trong khi những nguyên tố khác lại có thể hiện nhiều hóa trị khác nhau tùy vào điều kiện cụ thể của phản ứng mà chúng tham gia.
Bảng hóa trị các nguyên tố hoá học
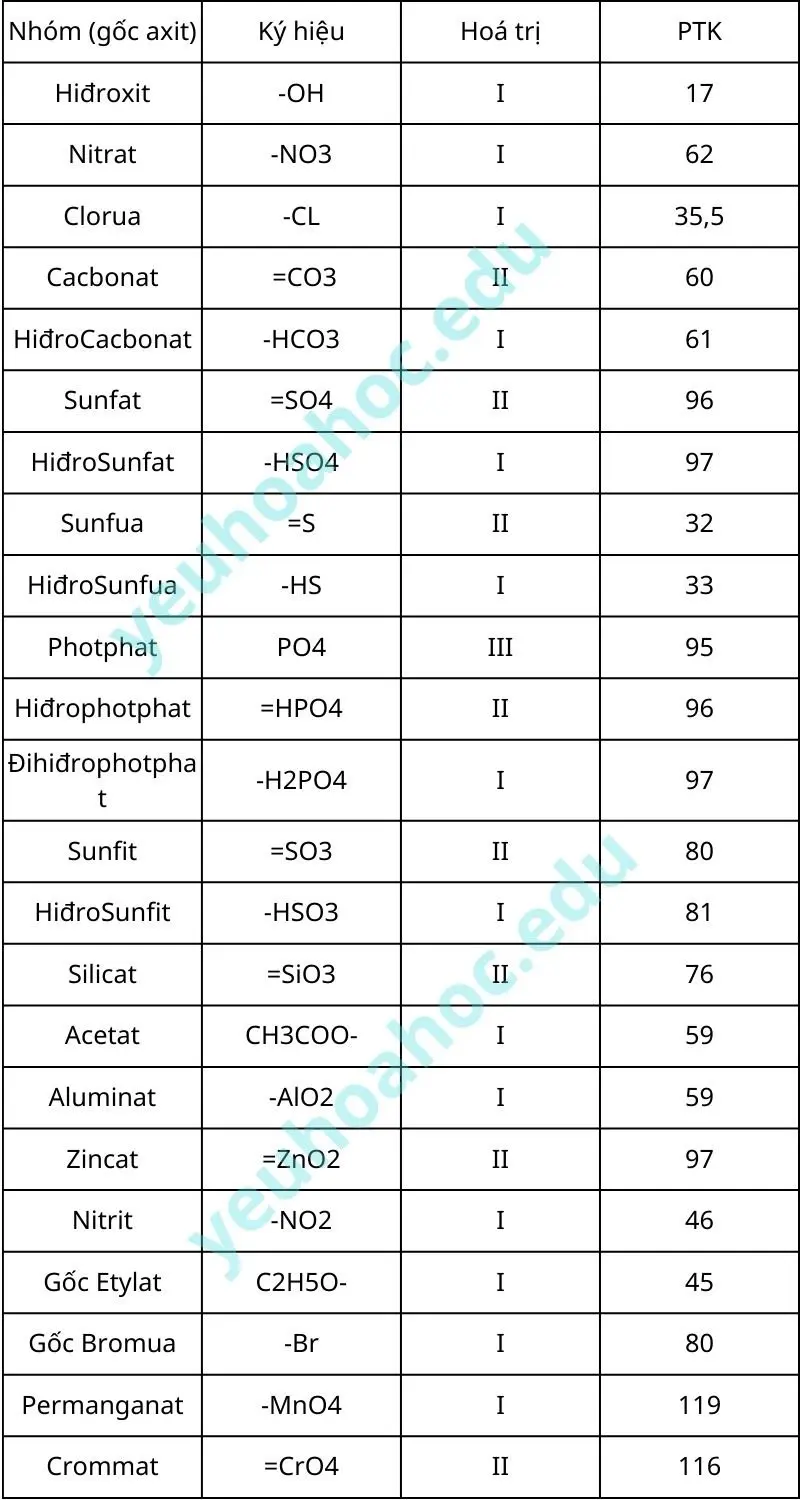
Bảng hoá trị một số nhóm nguyên tử
Nguyên tắc cần ghi nhớ về hóa trị
Nguyên tắc về hóa trị được phát biểu như sau: sản phẩm của chỉ số và hóa trị của một nguyên tố này sẽ bằng sản phẩm của chỉ số và hóa trị của nguyên tố còn lại trong hợp chất.
VD: xét hợp chất AB gồm hai nguyên tố:
Với: a,b là chỉ số; x,y là hoá trị
Theo nguyên tắc hóa trị, ta có phương trình: x.a = y.b
nếu biết x,y và a ta tìm được b : b =
nếu biết x,y và b ta tìm được a: a =
Khi đã xác định được giá trị của a và b, ta có thể xác định được giá trị của x và y để xây dựng công thức hóa học của hợp chất.
Biến đổi thành tỷ lệ:
Đặt x bằng với b (hoặc b’) và y bằng với a (hoặc a’), với điều kiện a’, b’ là các số nguyên giản hóa của a và b.
Áp dụng nguyên tắc này như sau:
Bằng cách áp dụng nguyên tắc hóa trị, việc xác định hóa trị của nguyên tố từ hóa trị và chỉ số của nguyên tố đối diện trở nên thuận tiện.
Hơn nữa, nguyên tắc này cũng hỗ trợ trong việc xác định công thức hóa học cho hợp chất, khi hóa trị của các nguyên tố trong hợp chất đã được biết trước.
Ví dụ vận dụng nguyên tắc hoá trị
Tìm hoá trị của nhôm (Al) trong hợp chất nhôm oxit (
) biết Oxi (O) có hoá trị là II
Gọi hoá trị cần tìm của Al là a
Áp dụng nguyên tắc hoá trị: a.x = b.y
Ta có: a.2 = 2.3 ⇒ a =
= 3
Vậy hoá trị cần tìm của Nhôm trong hợp chất là III
Tìm hoá trị của Sắt (Fe) trong hợp chất (
) biết gốc (=SO4) có hoá trị là II
Gọi hoá trị cần tìm của Fe là a
Áp dụng nguyên tắc hoá trị: a.x = b.y
Ta có: a.1 = 2.1 ⇒ a =
= 2
Vậy hoá trị cần tìm của Sắt trong hợp chất là II
Tìm hoá trị của Natri (Na) trong hợp chất (NaOH) Biết gốc (-OH) có hoá trị là I
Gọi hoá trị cần tìm của Na là a
Áp dụng nguyên tắc hoá trị: a.x = b.y
Ta có: a.1 = 1.1 ⇒ a = 1
Vậy hoá trị cần tìm của Natri trong hợp chất là I
Mẹo nhớ hoá trị nhanh và lâu nhất
Bài ca hoá trị cơ bản
Kali (K), Iot (I), Hydro (H)
Natri (Na), Bạc (Ag) vói Clo (Cl) cùng chung một loài
Là hoá trị I hỡi ai
Nhớ ghi cho kỹ khỏi hoài phân vân
Magie (Mg), Kẽm (Zn) với Thuỷ Ngân (Hg)
Oxi (O), Đồng (Cu), Thiếc (Sn), Bari (Ba)
Cuối cùng là chú Canxi (Ca)
Hoá trị II đó nhớ gì khó khăn
Này Nhôm (Al) hoá trị III lần
In sâu trí nhớ khi cần có ngay
Cacbon (Ca) Silic (Si) này đây
Có hoá trị IV không ngày nào quên
Sắt (Fe) lắm lúc hay phiền
II, III lên xuống nhớ liền ngay thôi
Lại gặp Nitơ (N) khó rồi
I, II, III, IV, khi thời lên V
Lưu huỳnh (S) lắm lúc chơi khoăm
Xuống II lên VI khi nằm thứ V
Photpho (P) nói đến không dư
Hễ ai hỏi đến thì ừ rằng V
Em ơi cố gắng học chăm
Bài ca hoá trị luôn luôn cần dùng.
Bài ca hoá trị nâng cao
Hydro (H) với Liti (Li),
Natri (Na), Kali (K) chẳng dời
Bạc (Ag) luôn tỏa sáng một trời
Chỉ có hoá trị I thôi chớ nhầm
Đồng (Cu), Thuỷ ngân (Hg) thường thấy,
Hoá trị II là chủ yếu, ít khi là I,
Chì (Pb) thay đổi, II hay IV,
Nhưng thường thấy hoá trị II là chính.
Oxy (O), Kẽm (Zn) luôn đi cùng,
Hoá trị II, không sao sai được,
Thêm vào đó là chú Canxi (Ca),
Magie (Mg), với Bari (Ba) cùng hội tụ.
Bo (B), Nhôm (Al) luôn giữ hoá trị III,
Cacbon (C), Silic (Si), Thiếc (Sn) giữ IV,
Nhưng đừng quên, hoá trị II vẫn là nơi để về,
Sắt (Fe) II không ổn định, thường chuyển sang III.
Photpho (P) III ít thấy,
Photpho (P) V thường gặp hơn nhiều,
Nitơ (N) hoá trị là bao nhiêu?
I, II, III, IV, V thường gặp nhất là V.
Lưu huỳnh (S) thường trêu chọc,
II, IV đến VI, biến đổi không ngừng,
Clo, Iod luôn biến động,
I là chính, nhưng II, III, V, VII cũng nhiều.
Mangan (Mn) phức tạp nhất rồi,
I đến VII, biến chuyển không yên,
Hoá trị II cũng thường dùng,
VII cũng quan trọng, đừng quên.
Bảng hoá trị, hãy thuộc lòng,
Giúp viết công thức, tránh sai lầm,
Chăm chỉ, cần mẫn trong học tập,
Ôn luyện không ngừng, sẽ nhớ lâu dài.