Axit là gì?
Axit là gì? Các loại axit, tính chất và ứng dụng. Bài viết này sẽ khám phá bản chất của axit, tính chất, phân loại và vai trò quan trọng trong đời sống.
Axit là một phần thiết yếu trong thế giới hóa học, sở hữu những đặc tính độc đáo và ứng dụng đa dạng. Bài viết này, yeuhoahoc.edu.vn sẽ cùng các bạn khám phá bản chất của axit, đi sâu vào tính chất, phân loại và vai trò quan trọng của chúng trong đời sống.
Axit là gì?
khái niệm
Định nghĩa axit:
Theo hóa học, axit là một hợp chất hóa học có thể nhường một hoặc nhiều proton (H+) cho dung dịch khi hòa tan trong nước. Khi hòa tan trong nước, axit làm giảm nồng độ ion H+ trong dung dịch, dẫn đến độ pH thấp hơn 7.
Có ba định nghĩa chính về axit:
- Theo Arrhenius: Axit là chất khi hòa tan trong nước tạo ra dung dịch có chứa ion H+.
- Theo Brønsted-Lowry: Axit là chất có khả năng cho proton (H+) cho chất nhận proton (bazơ).
- Theo Lewis: Axit là chất có khả năng nhận một cặp electron không chia sẻ từ bazơ.
Tính chất
Tính chất vật lý:
- Vị chua: Hầu hết các axit đều có vị chua, ví dụ như axit chanh, axit sunfuric.
- Làm đổi màu quỳ tím: Axit làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với kim loại: Axit tác dụng với một số kim loại (như kẽm, sắt) giải phóng khí hydro và tạo thành muối.
- Tác dụng với bazơ: Axit tác dụng với bazơ tạo ra sản phẩm muối và nước.
Tính chất hóa học:
a) Phản ứng trung hòa:
Axit tác dụng với bazơ tạo thành muối và nước. Đây là phản ứng hóa học quan trọng nhất của axit.
Ví dụ:
HCl + NaOH → NaCl + H2O
b) Phản ứng thế:
Axit tác dụng với một số kim loại (như kẽm, sắt) giải phóng khí hydro và tạo thành muối.
Ví dụ:
2HCl + Zn → ZnCl2 + H2
c) Phản ứng phân hủy:
Một số axit (như axit nitric) bị phân hủy khi đun nóng, giải phóng khí và tạo thành axit mới hoặc oxit axit.
Ví dụ:
4HNO3 → 2NO2 + O2 + 2H2O
Phân loại axit
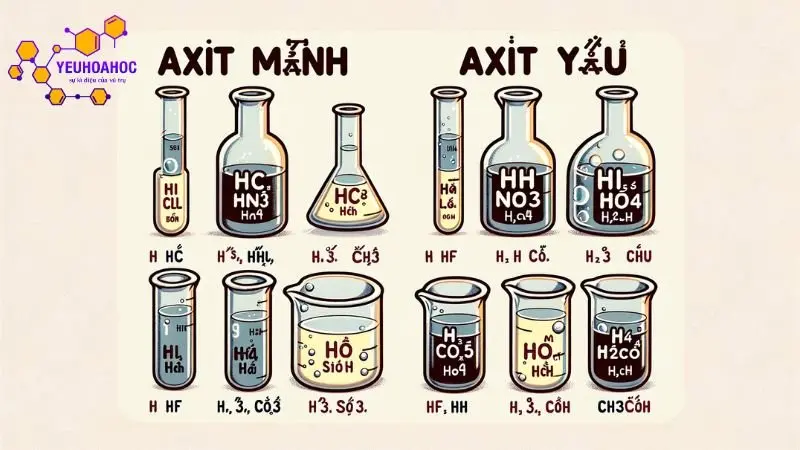
Phân loại theo tính mạnh/yếu
- Axit mạnh: Axit mạnh là những axit khi hòa tan trong nước, phân li hoàn toàn ra ion H+ và gốc axit. Axit mạnh có độ pH thấp (thường nhỏ hơn 2).
Ví dụ:
- Axit clohydric (HCl)
- Axit sunfuric (H2SO4)
- Axit nitric (HNO3)
- Axit yếu: Axit yếu là những axit khi hòa tan trong nước, chỉ phân li một phần ra ion H+ và gốc axit. Axit yếu có độ pH cao hơn axit mạnh (thường lớn hơn 2).
Ví dụ:
- Axit axetic (CH3COOH)
- Axit cacbonic (H2CO3)
- Axit sunfuric (H2SO4) (khi hòa tan loãng)
Nguyên nhân dẫn đến sự khác biệt về tính mạnh/yếu:
Tính mạnh/yếu của axit phụ thuộc vào độ bền của liên kết giữa nguyên tử H+ và gốc axit. Axit có liên kết H-X yếu hơn (dễ tách ra ion H+) sẽ là axit mạnh hơn. Ví dụ, axit clohydric (HCl) có liên kết H-Cl yếu hơn axit axetic (CH3COOH) do nguyên tử Cl hút electron mạnh hơn nguyên tử C, dẫn đến HCl là axit mạnh hơn.
Phân loại theo khả năng tan
- Axit tan trong nước: Hầu hết các axit đều tan trong nước, ví dụ như axit clohydric, axit sunfuric, axit axetic.
- Axit không tan trong nước: Một số ít axit không tan trong nước, ví dụ như axit silic (H2SiO3), axit photphoric (H3PO4) (khi cô đặc).
Nguyên nhân dẫn đến sự khác biệt về khả năng tan:
Khả năng tan của axit trong nước phụ thuộc vào tương tác giữa các phân tử axit và phân tử nước. Các axit có thể tạo liên kết hydro với phân tử nước sẽ dễ tan trong nước hơn. Ví dụ, axit clohydric (HCl) dễ tan trong nước do có thể tạo liên kết hydro mạnh với phân tử nước.
Phân loại theo nguồn gốc
- Axit vô cơ: Axit vô cơ là những axit không chứa nguyên tử cacbon trong phân tử. Axit vô cơ thường được hình thành từ các phản ứng hóa học giữa các nguyên tố phi kim và nước.
Ví dụ:
- Axit clohydric (HCl)
- Axit sunfuric (H2SO4)
- Axit nitric (HNO3)
- Axit hữu cơ: Axit hữu cơ là những axit có chứa nguyên tử cacbon trong phân tử. Axit hữu cơ thường được tìm thấy trong tự nhiên hoặc được tổng hợp từ các hợp chất hữu cơ khác.
Ví dụ:
- Axit axetic (CH3COOH)
- Axit citric (C6H8O7)
- Axit lactic (C3H6O3)
Nguyên nhân dẫn đến sự khác biệt về nguồn gốc:
Sự khác biệt về nguồn gốc của axit dẫn đến sự khác biệt về cấu tạo và tính chất của axit. Axit vô cơ thường có tính axit mạnh hơn axit hữu cơ do liên kết H-X trong axit vô cơ thường yếu hơn.
Ứng dụng của axit trong sản xuất và đời sống
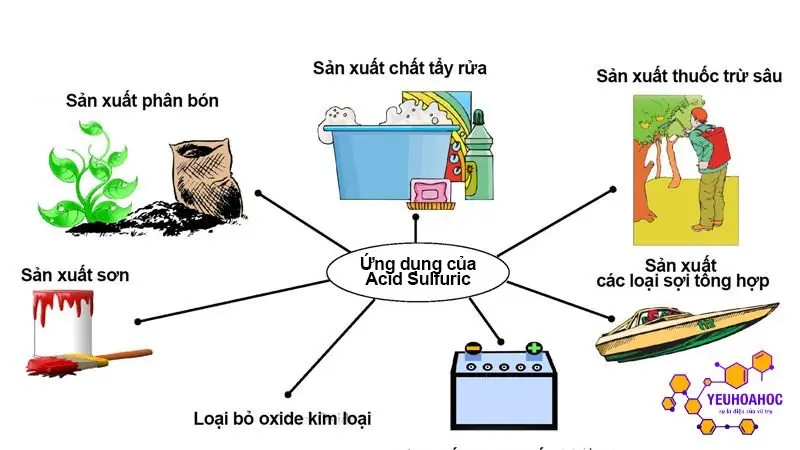
Lĩnh vực ứng dụng chính của axit
Công nghiệp hóa chất:
Ưu điểm:
- Axit đóng vai trò quan trọng trong sản xuất nhiều hóa chất thiết yếu như axit sunfuric (H2SO4), axit nitric (HNO3), axit clohydric (HCl), v.v.
- Axit được sử dụng trong sản xuất phân bón, thuốc nhuộm, chất dẻo, hóa chất tẩy rửa, pin, thuốc nổ, v.v.
Nhược điểm:
- Quá trình sản xuất và sử dụng axit có thể gây ô nhiễm môi trường nếu không được kiểm soát chặt chẽ.
- Axit là hóa chất nguy hiểm, có thể gây bỏng da, tổn thương mắt và các vấn đề sức khỏe khác nếu tiếp xúc trực tiếp.
Ngành thực phẩm:
Ưu điểm:
- Axit được sử dụng để tạo vị chua cho thực phẩm và đồ uống, ví dụ như axit citric trong nước ngọt, axit axetic trong giấm.
- Axit giúp bảo quản thực phẩm bằng cách ức chế sự phát triển của vi sinh vật, ví dụ như axit propionic trong bánh mì.
- Axit được sử dụng để làm mềm thịt và tăng hương vị cho thực phẩm, ví dụ như axit clohydric trong dưa muối.
Nhược điểm:
- Sử dụng quá nhiều axit có thể ảnh hưởng đến hương vị và chất lượng thực phẩm.
- Axit có thể gây hại cho hệ tiêu hóa nếu tiêu thụ quá nhiều.
Y học:
Ưu điểm:
- Axit được sử dụng để sản xuất thuốc, ví dụ như aspirin (axit acetylsalicylic).
- Axit được sử dụng để khử trùng dụng cụ y tế và bề mặt trong bệnh viện.
- Axit được sử dụng để điều trị một số bệnh lý như axit dạ dày.
Nhược điểm:
- Sử dụng axit sai cách có thể gây tác dụng phụ nguy hiểm, ví dụ như bỏng da, tổn thương mắt.
- Axit là hóa chất độc hại, cần được xử lý đúng cách để tránh gây ô nhiễm môi trường.
Nông nghiệp:
Ưu điểm:
- Axit được sử dụng để bón phân cho cây trồng, giúp cung cấp các chất dinh dưỡng cần thiết cho sự phát triển của cây.
- Axit được sử dụng để điều chỉnh độ pH của đất, tạo môi trường thích hợp cho cây trồng phát triển.
- Axit được sử dụng để kiểm soát cỏ dại và sâu bệnh hại cây trồng.
Nhược điểm:
- Sử dụng axit quá nhiều có thể gây hại cho đất và nguồn nước.
- Axit có thể ảnh hưởng đến hệ sinh thái tự nhiên.
Gia đình:
Ưu điểm:
- Axit được sử dụng để tẩy rửa nhà cửa, giúp loại bỏ bụi bẩn, vi khuẩn và nấm mốc.
- Axit được sử dụng để khử trùng các bề mặt trong nhà, giúp ngăn ngừa sự phát triển của vi sinh vật có hại.
- Axit được sử dụng để làm sạch các vật dụng bằng kim loại, giúp loại bỏ gỉ sét và làm sáng bóng.
Nhược điểm:
- Axit là hóa chất nguy hiểm, cần được sử dụng cẩn thận để tránh gây hại cho sức khỏe và môi trường.
- Axit có thể làm hỏng các vật dụng bằng gỗ, da và vải.
Các phương pháp bảo đảm an toàn trong khi dùng và lưu trữ axit
- Luôn đeo găng tay, kính bảo hộ và quần áo bảo hộ khi sử dụng axit.
- Làm việc trong khu vực thông gió tốt.
- Tránh để axit tiếp xúc với da, mắt và quần áo.
- Rửa sạch da và mắt ngay lập tức bằng nước sạch nếu bị axit dính vào.
- Bảo quản axit trong các bình kín, dán nhãn cẩn thận và để xa tầm tay trẻ em.
- Xử lý axit thải đúng cách để tránh gây ô nhiễm môi trường.
Tác động của axit đến môi trường và sức khỏe con người
Tác động tiêu cực của axit đối với môi trường
- Gây ô nhiễm nguồn nước: Khi axit thải ra môi trường, chúng sẽ hòa tan vào nước, làm giảm độ pH của nước, ảnh hưởng đến hệ sinh thái thủy sinh. Nước có tính axit cao có thể gây hại cho cá, sinh vật phù du và các vi sinh vật khác, đồng thời ảnh hưởng đến chất lượng nước uống cho con người.
- Gây ô nhiễm không khí: Khi axit được thải ra môi trường, chúng có thể kết hợp với các chất khác trong không khí tạo thành các chất ô nhiễm như bụi mịn, SO2, NO2, v.v. Các chất ô nhiễm này có thể gây ra các bệnh về đường hô hấp như hen suyễn, viêm phổi, v.v., đồng thời góp phần vào hiện tượng biến đổi khí hậu.
- Gây ô nhiễm đất: Khi axit được thải ra đất, chúng có thể làm giảm độ pH của đất, ảnh hưởng đến khả năng hấp thụ dinh dưỡng của cây trồng. Đất có tính axit cao có thể làm cho một số loại cây trồng không thể phát triển được. Axit trong đất cũng có thể làm cho các kim loại nặng trong đất dễ hòa tan hơn, gây ô nhiễm nguồn nước và ảnh hưởng đến sức khỏe con người.
- Gây hại cho các sinh vật sống: Axit có thể gây hại cho các sinh vật sống ở mọi cấp độ trong hệ sinh thái, từ vi sinh vật đến thực vật và động vật. Axit có thể làm hỏng các cơ quan hô hấp, tiêu hóa và sinh sản của sinh vật, đồng thời ảnh hưởng đến khả năng sinh sản và phát triển của chúng.
- Gây ra các hiện tượng biến đổi khí hậu: Axit, đặc biệt là CO2, là một trong những khí nhà kính chính góp phần vào hiện tượng biến đổi khí hậu. Biến đổi khí hậu dẫn đến nhiều hậu quả nghiêm trọng như nước biển dâng cao, hạn hán, lũ lụt, v.v., ảnh hưởng đến đời sống và sản xuất của con người.
Tác hại của axit đối với sức khỏe con người
- Gây bỏng da, mắt và các cơ quan khác: Khi tiếp xúc trực tiếp với axit, con người có thể bị bỏng da, mắt và các cơ quan khác. Mức độ tổn thương phụ thuộc vào nồng độ axit, thời gian tiếp xúc và vị trí tiếp xúc.
- Gây ngộ độc, ảnh hưởng đến hệ hô hấp, tiêu hóa và thần kinh: Khi hít phải hoặc nuốt axit, con người có thể bị ngộ độc. Triệu chứng ngộ độc axit bao gồm buồn nôn, nôn mửa, tiêu chảy, đau bụng, khó thở, ho, v.v. Trong trường hợp nặng, ngộ độc axit có thể dẫn đến tử vong.
- Gây ung thư và các bệnh lý nguy hiểm khác: Tiếp xúc với axit trong thời gian dài có thể làm tăng nguy cơ mắc các bệnh ung thư như ung thư phổi, ung thư da, ung thư dạ dày, v.v. Axit cũng có thể gây ra các bệnh lý nguy hiểm khác như loãng xương, bệnh tim mạch, v.v.
Giải pháp để giảm thiểu tác động tiêu cực của axit
- Sử dụng axit một cách hợp lý và tiết kiệm: Cần sử dụng axit một cách hợp lý và tiết kiệm, tránh lãng phí và thất thoát. Nên áp dụng các biện pháp để tái sử dụng và tái chế axit whenever possible.
- Xử lý nước thải có chứa axit trước khi thải ra môi trường: Nước thải có chứa axit cần được xử lý trước khi thải ra môi trường để đảm bảo an toàn cho sức khỏe con người và môi trường. Có nhiều phương pháp xử lý nước thải có chứa axit khác nhau, cần lựa chọn phương pháp phù hợp với từng trường hợp cụ thể.
- Nâng cao ý thức bảo vệ môi trường và sức khỏe cộng đồng: Cần nâng cao ý thức bảo vệ môi trường và sức khỏe cộng đồng để mọi người sử dụng axit một cách an toàn và có trách nhiệm. Cần tuyên truyền giáo dục về tác hại của axit đối với môi trường và sức khỏe con người, đồng thời hướng dẫn mọi người cách sử dụng axit an toàn.
Các câu hỏi hay thường gặp về axit
1. Axit là gì và chúng hoạt động như thế nào?
Đáp án:
Axit là những hợp chất có khả năng nhường proton (H+) khi hòa tan trong nước, làm cho dung dịch có tính axit. Chúng có vị chua và có khả năng biến giấy quỳ tím thành đỏ. Axit mạnh là những chất có khả năng nhường proton hoàn toàn trong dung dịch, trong khi axit yếu chỉ nhường proton một phần.
2. Làm thế nào để xác định một chất là axit mạnh hay yếu?
Đáp án:
Để xác định axit mạnh hay yếu, ta có thể dựa vào giá trị hằng số phân li axit (Ka). Axit mạnh có giá trị Ka lớn, cho thấy chúng nhường proton dễ dàng và hoàn toàn. Ví dụ, axit hydrochloric (HCl) là một axit mạnh vì nó hoàn toàn phân li trong nước. Axit yếu như axit axetic (CH3COOH) có giá trị Ka nhỏ, chỉ một phần nhỏ các phân tử nhường proton trong dung dịch.
3. Tại sao axit nitric có thể ăn mòn kim loại?
Đáp án:
Axit nitric (HNO3) là một axit mạng và oxy hóa mạnh. Khi tiếp xúc với kim loại, axit nitric không chỉ nhường proton để hình thành ion hydro, mà còn oxy hóa kim loại. Quá trình này biến kim loại thành ion dương, điều này làm kim loại bị hòa tan và thường tạo ra khí hydro hoặc các oxit của nitơ.
4. Axit có vai trò gì trong tiêu hóa thức ăn?
Đáp án:
Trong quá trình tiêu hóa, axit hydrochloric (HCl) trong dạ dày giúp phá vỡ thức ăn bằng cách kích hoạt enzyme pepsin, làm đông tụ protein, và giúp tiêu diệt vi khuẩn có hại. Axit này tạo môi trường thích hợp cho các phản ứng tiêu hóa diễn ra hiệu quả, làm chuyển hóa thức ăn thành dạng lỏng để dễ dàng di chuyển vào ruột non cho các quá trình hấp thụ chất dinh dưỡng.
5. Có thể trung hòa axit bằng cách nào?
Đáp án:
Trung hòa axit có thể thực hiện bằng cách thêm một bazơ, như natri hydroxit (NaOH) hoặc canxi hydroxit (Ca(OH)2), vào dung dịch axit. Quá trình này tạo ra nước (H2O) và muối, qua phản ứng: Axit + Bazơ -> Muối + Nước. Độ pH của dung dịch sau phản ứng trung hòa sẽ gần với trung tính, phụ thuộc vào tỉ lệ axit và bazơ được sử dụng.
6. Tại sao axit lại có tính ăn mòn cao?
Axit có tính ăn mòn cao do khả năng phản ứng mạnh với nhiều chất khác nhau, đặc biệt là kim loại và các hợp chất hữu cơ. Khi làm việc với axit, cần tuân thủ các biện pháp an toàn sau:
– Đeo găng tay bảo hộ, kính bảo hộ và áo khoác phòng thí nghiệm.
– Sử dụng axit trong khu vực thông gió tốt.
– không được để axit dính trực tiếp với da và mắt.
– Lưu trữ axit ở nơi an toàn, tránh xa tầm tay trẻ em.
Axit là một chất hóa học mạnh mẽ với nhiều ứng dụng quan trọng. Tuy nhiên, việc sử dụng và bảo quản axit cần được thực hiện cẩn thận để đảm bảo an toàn cho con người và môi trường. Hiểu rõ về axit sẽ giúp chúng ta sử dụng chúng một cách hiệu quả và có trách nhiệm.







