Axit Cacbonic
Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cho bạn những thông tin chi tiết về Axit cacbonic: Khái niệm, tính chất và cách điều chế.
Axit Cacbonic , hay còn gọi là axit carbonic, là một hợp chất hóa học vô cơ quan trọng với nhiều ứng dụng trong đời sống. Chất khí không màu này đóng vai trò thiết yếu trong quá trình hô hấp của sinh vật, sản xuất nước giải khát, luyện kim và nhiều lĩnh vực khác. Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp cho bạn những thông tin chi tiết về Axit cacbonic, bao gồm tính chất, cách điều chế, ứng dụng và tác động môi trường.
Khái niệm về Axit Cacbonic
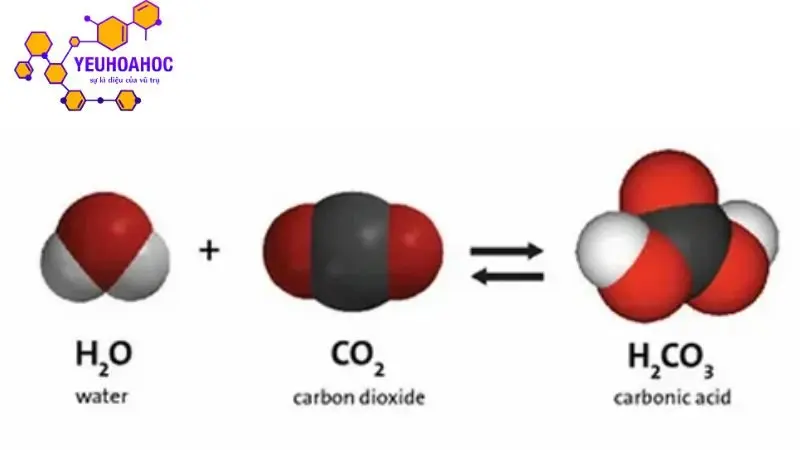
Axit cacbonic (hay axit carbonic) là một hợp chất vô cơ có công thức hóa học H2CO3. Nó được tạo thành khi khí cacbon dioxide (CO2) hòa tan trong nước. Tuy nhiên, axit cacbonic là một axit yếu và không bền, dễ dàng bị phân hủy thành CO2 và nước.
Vai trò quan trọng:
Trong đời sống
- Thành phần của nước giải khát: Axit cacbonic tạo nên vị chua nhẹ và bọt khí trong các loại nước giải khát có ga như soda, nước chanh,…
- Điều hòa pH trong máu: Hệ thống đệm cacbonat đóng vai trò quan trọng trong việc điều hòa pH máu, giúp duy trì môi trường axit-bazơ ổn định trong cơ thể.
- Tham gia vào quá trình quang hợp: Cây xanh sử dụng CO2 từ khí quyển để tổng hợp carbohydrate thông qua quá trình quang hợp.
Trong sản xuất
- Sản xuất muối cacbonat: Axit cacbonic được sử dụng để sản xuất muối cacbonat, ví dụ như Na2CO3 (soda), CaCO3 (đá vôi),… Muối cacbonat có nhiều ứng dụng trong công nghiệp như sản xuất thủy tinh, xi măng, thuốc,…
- Làm sạch kim loại: Axit cacbonic được dùng để tẩy rửa rỉ sét trên bề mặt kim loại.
- Thu hồi khí CO2: Trong một số ngành công nghiệp, axit cacbonic được tạo ra như sản phẩm phụ. Sau đó, CO2 có thể được thu hồi và sử dụng cho các mục đích khác, ví dụ như sản xuất nước giải khát có ga hoặc làm lạnh thực phẩm.
Tính chất của Axit Cacbonic
Tính chất vật lý
Trạng thái:
- Chất lỏng không màu: Axit cacbonic tồn tại ở dạng lỏng ở điều kiện thường, không phải khí như thông tin bạn cung cấp trước đây.
- Có thể đóng băng: Axit cacbonic có thể đóng băng ở nhiệt độ thấp (-56,6°C).
Mùi:
- Không mùi: Axit cacbonic không có mùi đặc trưng.
Vị:
- Vị chua nhẹ: Khi nếm thử, axit cacbonic có vị chua nhẹ do tính axit của nó.
Khối lượng riêng:
- Nặng hơn nước: Axit cacbonic có khối lượng riêng 1,53 g/cm³ (ở 20°C), nặng hơn nước (1 g/cm³).
Độ tan trong nước:
- Tan tốt trong nước: Axit cacbonic tan tốt trong nước. Tỷ lệ hòa tan của CO2 trong nước phụ thuộc vào nhiệt độ và áp suất. Nồng độ CO2 hòa tan trong nước càng cao khi nhiệt độ thấp và áp suất cao.
Điểm sôi:
- Khoảng 64°C (ở áp suất khí quyển): Axit cacbonic sôi ở nhiệt độ tương đối thấp (khoảng 64°C) so với các axit khác.
Điểm nóng chảy:
- Khoảng -56,6°C: Axit cacbonic đóng băng ở nhiệt độ thấp (-56,6°C).
Lưu ý:
- Khi đun nóng hoặc để lâu trong không khí, axit cacbonic dễ bị phân hủy thành khí CO2 và nước.
- Axit cacbonic là một axit yếu, chỉ phân li một phần trong dung dịch.
- Axit cacbonic có thể gây kích ứng da và mắt. Do đó, cần cẩn thận khi tiếp xúc với hóa chất này và tuân thủ các biện pháp an toàn khi sử dụng.
Tính chất hóa học
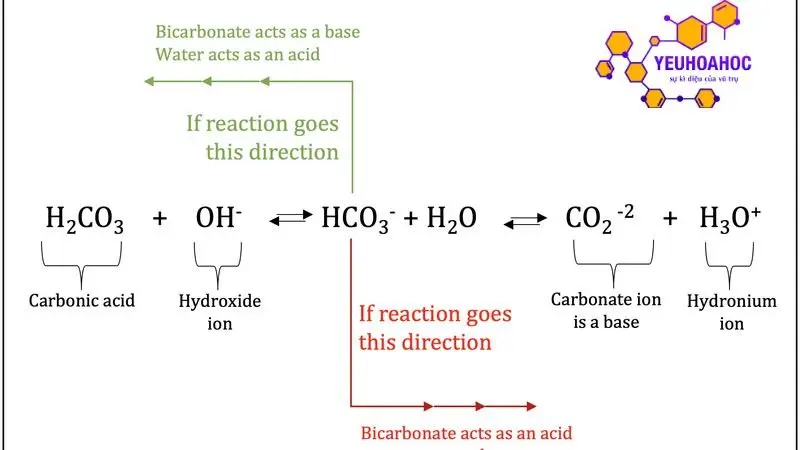
Axit cacbonic là một axit yếu, không bền và có hai phản ứng hóa học chính:
- Phản ứng với bazơ:
Axit cacbonic tác dụng với bazơ (NaOH, KOH, Ca(OH)2,…) tạo ra muối cacbonat và nước.
Ví dụ:
- Phân hủy:
Khi đun nóng hoặc để lâu trong không khí, axit cacbonic dễ bị phân hủy thành khí CO2 và nước.
Ví dụ:
Ngoài ra, axit cacbonic còn có một số phản ứng khác:
- Tác dụng với một số kim loại: Một số kim loại hoạt động mạnh như Mg, Al có thể tác dụng với axit cacbonic giải phóng khí CO2 và tạo ra muối.
- Tác dụng với dung dịch muối axit mạnh: Axit cacbonic bị đẩy ra khỏi muối bởi axit mạnh hơn.
Cách điều chế Axit Cacbonic
Trong tự nhiên
Hô hấp của sinh vật:
- Quá trình hô hấp của tất cả các sinh vật sống trên Trái Đất đều thải ra khí CO2. CO2 này hòa tan trong nước tạo thành axit cacbonic.
- Ví dụ:
- Con người và động vật: Khi thở ra, chúng ta thải ra CO2. CO2 này hòa tan trong nước bọt và tạo thành axit cacbonic.
- Cây xanh: Ban đêm, cây xanh cũng thải ra CO2 trong quá trình hô hấp. CO2 này hòa tan trong nước mưa hoặc nước trong đất tạo thành axit cacbonic.
Phân hủy các hợp chất hữu cơ:
- Khi các hợp chất hữu cơ như xác chết động thực vật, lá cây mục nát,… phân hủy trong điều kiện thiếu oxy, CO2 được giải phóng và hòa tan trong nước tạo thành axit cacbonic.
- Quá trình này diễn ra ở cả trên cạn và dưới nước.
Ngoài ra, axit cacbonic còn được tạo ra trong một số hiện tượng tự nhiên khác:
- Núi lửa phun trào: Khi núi lửa phun trào, chúng giải phóng ra một lượng lớn khí CO2 vào khí quyển. CO2 này hòa tan trong nước mưa tạo thành axit cacbonic.
- Suối nước nóng: Một số suối nước nóng có chứa CO2 hòa tan trong nước, tạo thành axit cacbonic.
Trong phòng thí nghiệm
- Phản ứng giữa axit clohidric (HCl) và canxi cacbonat (CaCO3):
Đây là phương pháp phổ biến nhất để điều chế axit cacbonic trong phòng thí nghiệm.
Phương trình hóa học:
Cách thực hiện:
- Cho đá vôi (CaCO3) đã nghiền nhỏ vào bình tam giác.
- Đổ dung dịch HCl loãng vào bình tam giác sao cho lượng HCl dư.
- Đậy nút bình tam giác bằng ống dẫn khí và dẫn khí thoát ra vào bình đựng nước vôi trong.
- Quan sát hiện tượng: Bọt khí CO2 thoát ra từ bình tam giác, làm đục nước vôi trong.
Lưu ý:
- Cần cẩn thận khi thực hiện thí nghiệm vì axit clohidric có thể gây bỏng.
- Nên sử dụng kính bảo hộ và găng tay khi làm việc với hóa chất.
- Phản ứng phân hủy muối cacbonat:
Một số muối cacbonat, như NaHCO3 (baking soda), có thể bị phân hủy khi đun nóng, giải phóng khí CO2.
Phương trình hóa học:
Cách thực hiện:
- Cho NaHCO3 vào ống nghiệm.
- Đun nóng ống nghiệm trên ngọn đèn cồn.
- Quan sát hiện tượng: Bọt khí CO2 thoát ra từ ống nghiệm.
Lưu ý:
- Cần cẩn thận khi đun nóng ống nghiệm vì có thể xảy ra hiện tượng bắn.
- Nên sử dụng giá đỡ ống nghiệm để đảm bảo an toàn.
- Sử dụng bình khí nén CO2:
Có thể mua bình khí nén CO2 để sử dụng trong thí nghiệm.
Cách thực hiện:
- Gắn bình khí nén CO2 với ống dẫn khí.
- Đưa khí CO2 vào bình đựng nước vôi trong.
- Quan sát hiện tượng: Bọt khí CO2 thoát ra từ bình khí nén, làm đục nước vôi trong.
Lưu ý:
- Cần cẩn thận khi sử dụng bình khí nén CO2 vì có thể gây nguy hiểm nếu không được bảo quản và sử dụng đúng cách.
- Cần phải tuân thủ hướng dẫn sử dụng của nhà sản xuất.
Ngoài ra, còn có một số cách điều chế axit cacbonic khác, ví dụ như:
Trong công nghiệp
Phân hủy muối cacbonat:
Phương pháp này sử dụng nhiệt để phân hủy muối cacbonat thành oxit cacbon (CO2) và nước (H2O). Sau đó, CO2 được dẫn qua nước để tạo thành axit cacbonic.
Ví dụ:
Ưu điểm:
- Dễ dàng thực hiện.
- Nguyên liệu rẻ và sẵn có.
Nhược điểm:
- Cần sử dụng nhiệt độ cao.
- Sản phẩm thu được có thể vẫn lẫn tạp chất.
Đốt cháy nhiên liệu:
Phương pháp này đốt cháy các nhiên liệu hóa thạch như than, dầu mỏ, khí đốt,… để tạo ra CO2. Sau đó, CO2 được dẫn qua nước để tạo thành axit cacbonic.
Ví dụ:
- Đốt cháy than:
Ưu điểm:
- Sản lượng CO2 cao.
Nhược điểm:
- Gây ô nhiễm môi trường.
- Cần có thiết bị chuyên dụng để thu hồi CO2.
Ngoài ra, axit cacbonic cũng có thể được tạo ra từ quá trình lên men rượu bia và hô hấp của sinh vật.
Ứng dụng của Axit Cacbonic
Trong thực phẩm và đồ uống:
- Tạo độ sủi cho nước ngọt, bia: Axit cacbonic được sử dụng để tạo bọt khí cho nước ngọt, bia, giúp tạo cảm giác sảng khoái khi thưởng thức.
- Làm chất bảo quản thực phẩm: Axit cacbonic có khả năng ức chế sự phát triển của vi sinh vật, do đó được sử dụng để bảo quản thực phẩm như thịt, cá, rau quả.
- Dùng trong sản xuất bánh kẹo, kem: Axit cacbonic được sử dụng để tạo độ xốp cho bánh kẹo, kem, giúp tạo nên hương vị và kết cấu hấp dẫn.
Trong công nghiệp:
- Sản xuất nước đá khô: Nước đá khô (CO2 rắn) được sử dụng để bảo quản thực phẩm, dược phẩm, vận chuyển hàng hóa dễ hỏng.
- Dùng trong luyện kim: Axit cacbonic được sử dụng để loại bỏ tạp chất trong quá trình sản xuất thép.
- Làm chất tẩy rửa: Axit cacbonic được sử dụng để tẩy rửa các bề mặt kim loại, giúp loại bỏ gỉ sét và bụi bẩn.
- Dùng trong xử lý nước thải: Axit cacbonic được sử dụng để trung hòa nước thải có tính kiềm, giúp bảo vệ môi trường.
Trong nông nghiệp:
- Kích thích sinh trưởng cây trồng: Axit cacbonic cung cấp nguồn carbon cho cây trồng, giúp thúc đẩy quá trình quang hợp và phát triển.
- Nuôi dưỡng vi sinh vật có lợi cho đất: Axit cacbonic giúp tạo môi trường sống cho các vi sinh vật có lợi trong đất, góp phần cải thiện chất lượng đất.
Tác hại của Axit Cacbonic
Gây hại cho sức khỏe:
- Kích ứng da và mắt: Tiếp xúc trực tiếp với axit cacbonic dạng lỏng hoặc khí CO2 có thể gây kích ứng da và mắt, dẫn đến các triệu chứng như ngứa rát, đỏ da, chảy nước mắt.
- Gây ngạt thở: Khi nồng độ CO2 trong không khí cao (> 5%), nó có thể gây ngạt thở do thiếu oxy. Nồng độ CO2 cao có thể gặp trong các không gian kín đáo, thiếu thông gió, hoặc nơi có sử dụng nhiều axit cacbonic.
- Ảnh hưởng đến hệ hô hấp: Hít phải lượng lớn CO2 trong thời gian dài có thể gây tổn thương phổi, ảnh hưởng đến chức năng hô hấp và dẫn đến các bệnh về hô hấp như hen suyễn, viêm phế quản mãn tính.
- Axit hóa đại dương: Khi CO2 từ khí quyển hòa tan vào nước biển, nó làm tăng tính axit của nước biển, ảnh hưởng đến các sinh vật biển, đặc biệt là các sinh vật có vỏ như san hô và động vật thân mềm.
Gây ô nhiễm môi trường:
- Gây hiệu ứng nhà kính: CO2 là một khí nhà kính chính, góp phần làm tăng nhiệt độ Trái đất, dẫn đến biến đổi khí hậu, tan chảy chỏm băng, mực nước biển dâng cao, và các hiện tượng thời tiết cực đoan.
- Gây mưa axit: Khi CO2 trong khí quyển kết hợp với nước và các chất ô nhiễm khác, nó tạo thành axit sulfuric và axit nitric, gây ra mưa axit. Mưa axit có thể làm ảnh hưởng đến đất, nước, và các sinh vật trên Trái đất.
Nguy cơ cháy nổ:
- Khí CO2 nặng hơn không khí: Khí CO2 nặng hơn không khí, do đó nó có thể tích tụ ở những nơi thấp, tạo nguy cơ ngạt thở và cháy nổ.
- Nguy cơ cháy nổ trong môi trường kín: Trong môi trường kín, khí CO2 có thể đẩy lùi oxy, tạo điều kiện cho cháy nổ xảy ra.
Biện pháp hạn chế tác hại của Axit Cacbonic
Hạn chế sử dụng nhiên liệu hóa thạch:
- Năng lượng hóa thạch như than đá, dầu mỏ, khí đốt là nguồn phát thải CO2 chính vào khí quyển.
- Hạn chế sử dụng các phương tiện giao thông sử dụng nhiên liệu hóa thạch, chuyển sang sử dụng phương tiện giao thông công cộng, xe đạp, đi bộ.
Trồng nhiều cây xanh
- Cây xanh có khả năng hấp thụ CO2 và giải phóng oxy, góp phần giảm lượng CO2 trong khí quyển.
- Khuyến khích trồng cây xanh trong nhà, khu vực sinh hoạt, khu công cộng.
- Tham gia các hoạt động trồng rừng, bảo vệ rừng.
Sử dụng năng lượng tái tạo:
- Năng lượng tái tạo như năng lượng mặt trời, năng lượng gió, năng lượng thủy điện không thải ra CO2.
- Sử dụng các thiết bị sử dụng năng lượng tái tạo như pin mặt trời, tuabin gió.
- Hỗ trợ phát triển các dự án điện năng tái tạo.
Nâng cao ý thức bảo vệ môi trường:
- Tăng cường tuyên truyền, giáo dục về tác hại của axit cacbonic và các biện pháp hạn chế.
- Khuyến khích người dân nên dùng các sản phẩm thân thiện với môi trường.
- Tham gia các hoạt động bảo vệ môi trường như dọn dẹp vệ sinh, trồng cây xanh.
Axit cacbonic là một hợp chất linh hoạt có nhiều ứng dụng trong thực tiễn. Tuy nhiên, việc sản xuất và sử dụng Axit cacbonic cũng có thể gây ra một số tác động tiêu cực đến môi trường. Việc sử dụng Axit cacbonic một cách hợp lý và có trách nhiệm là điều cần thiết để bảo vệ môi trường và đảm bảo sự phát triển bền vững.







