Axit acetic
Bài viết này, yeuhoahoc.edu.vn sẽ đi sâu tìm hiểu về axit acetic, bao gồm tính chất, phương pháp điều chế, ứng dụng và tác hại của nó.
Axit acetic, một hợp chất hữu cơ quen thuộc, đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống. Từ vai trò tạo nên vị chua đặc trưng cho giấm ăn, đến ứng dụng rộng rãi trong sản xuất công nghiệp, axit acetic luôn hiện diện và mang lại nhiều lợi ích cho con người. Bài viết này, yeuhoahoc.edu.vn sẽ đi sâu tìm hiểu về axit acetic, bao gồm tính chất, phương pháp điều chế, ứng dụng và tác hại của nó.
Giới thiệu về axit acetic
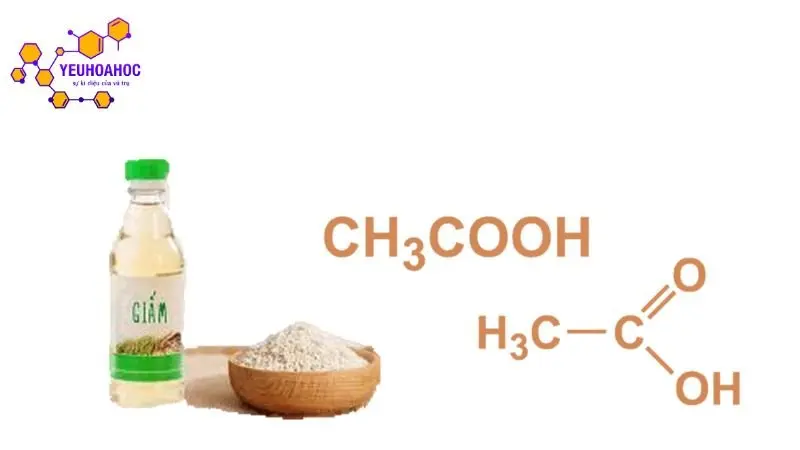
Định nghĩa axit acetic:
Axit acetic, hay còn gọi là axit etanoic hoặc giấm ăn, là một axit hữu cơ đơn giản nhất với công thức hóa học CH3COOH. Đó là một dạng lỏng trong suốt, vị chua và hòa tan hoàn toàn trong nước. Axit acetic là thành phần chính của giấm, chiếm khoảng 4% – 8% thể tích.
Công thức hóa học:
Lịch sử phát triển:
Axit acetic đã được biết đến từ thời cổ đại. Người Ai Cập cổ đại đã sử dụng giấm để bảo quản thực phẩm và làm thuốc. Vào thế kỷ 12, nhà giả kim người Ả Rập Jabir ibn Hayyan đã cô lập axit acetic tinh khiết bằng cách chưng cất giấm.
Vào thế kỷ 18, nhà hóa học người Pháp Antoine Lavoisier đã xác định thành phần của axit acetic. Ông đã đặt tên cho nó là “acide acétique”, có nghĩa là “axit có vị chua”.
Vào thế kỷ 19, nhà hóa học người Đức Carl Friedrich Gauss đã tổng hợp axit acetic từ etanol và axit nitric. Phương pháp tổng hợp này vẫn được sử dụng cho đến ngày nay.
Tính chất của axit acetic
Tính chất vật lý
- Trạng thái: Lỏng không màu, có mùi đặc trưng.
- Nhiệt độ sôi: 118°C
- Nhiệt độ nóng chảy: 16,7°C
- Khối lượng riêng: 1,049 g/cm³
- Độ hòa tan: Tan vô hạn trong nước, tan tốt trong các dung môi hữu cơ như etanol, axeton, ether.
Tính chất hóa học
Tính axit:
- Axit acetic là một axit yếu, có độ pH khoảng 4,7.
- Axit acetic có thể tác dụng với kim loại, bazơ, oxit bazơ và muối của axit yếu hơn để tạo ra muối và nước.
Ví dụ:
Phản ứng este hóa
- Axit acetic có thể tác dụng với ancol để tạo ra este và nước.
Ví dụ:
Phản ứng amid hóa:
- Axit acetic có thể tác dụng với amoniac để tạo ra amit và nước.
Ví dụ:
Phản ứng axit hóa:
- Axit acetic có thể tác dụng với một số hợp chất hữu cơ khác để tạo ra các dẫn xuất axit.
Ví dụ:
Phương pháp sản xuất và điều chế axit acetic
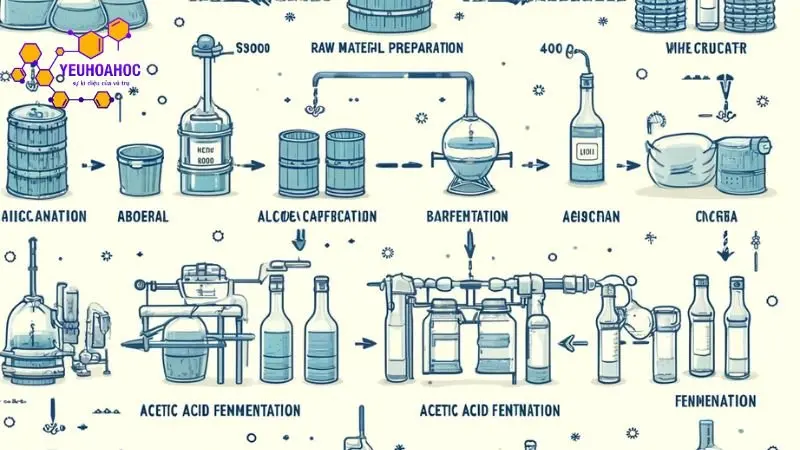
Phương pháp lên men
Phương pháp lên men là phương pháp truyền thống được sử dụng để sản xuất axit acetic từ lâu đời. Quá trình lên men được thực hiện bởi các vi sinh vật, chủ yếu là vi khuẩn Acetobacter và Zymomonas mobilis.
Quá trình lên men diễn ra theo các bước sau:
- Bước 1: Chuẩn bị nguyên liệu: Nguyên liệu để lên men axit acetic có thể là các loại ngũ cốc (gạo, nếp, bắp…), trái cây (chuối, táo…), hoặc các phụ phẩm nông nghiệp (mật mía, rỉ mật).
- Bước 2: Xử lý nguyên liệu: Nguyên liệu được nghiền nhỏ và nấu chín để chuyển hóa tinh bột thành đường.
- Bước 3: Lên men: Nước đường được pha loãng và cấy vi sinh vật Acetobacter hoặc Zymomonas mobilis. Vi sinh vật sẽ chuyển hóa đường thành axit acetic và etanol.
- Bước 4: Thu hồi axit acetic: Dung dịch lên men được chưng cất để thu hồi axit acetic.
Phương trình phản ứng hóa học:
Phương pháp tổng hợp hóa học
Phương pháp tổng hợp hóa học là phương pháp sản xuất axit acetic hiện đại được sử dụng phổ biến nhất hiện nay. Phương pháp này có thể sử dụng nhiều nguyên liệu khác nhau, nhưng phổ biến nhất là metanol và cacbon monoxit.
Quá trình tổng hợp hóa học diễn ra theo các bước sau:
- Bước 1: Xử lý nguyên liệu: Methanol và cacbon monoxit được tinh chế và nén ở áp suất cao.
- Bước 2: Phản ứng tổng hợp: Methanol và cacbon monoxit được đưa vào lò phản ứng cùng với xúc tác là paladi hoặc rhodi. Phản ứng xảy ra ở nhiệt độ cao (khoảng 200°C) và áp suất cao (khoảng 30 atm).
Phương trình phản ứng hóa học:
- So sánh hai phương pháp:
| Phương pháp | Ưu điểm | Nhược điểm |
| Lên men | – Sử dụng nguyên liệu tự nhiên, an toàn cho sức khỏe.<br>- Chi phí sản xuất thấp. | – Năng suất thấp.<br>- Quá trình sản xuất lâu. |
| Tổng hợp hóa học | – Năng suất cao.<br>- Quá trình sản xuất nhanh. | – Sử dụng nguyên liệu hóa học, có thể gây hại cho môi trường.<br>- Chi phí sản xuất cao. |
Ứng dụng của axit acetic
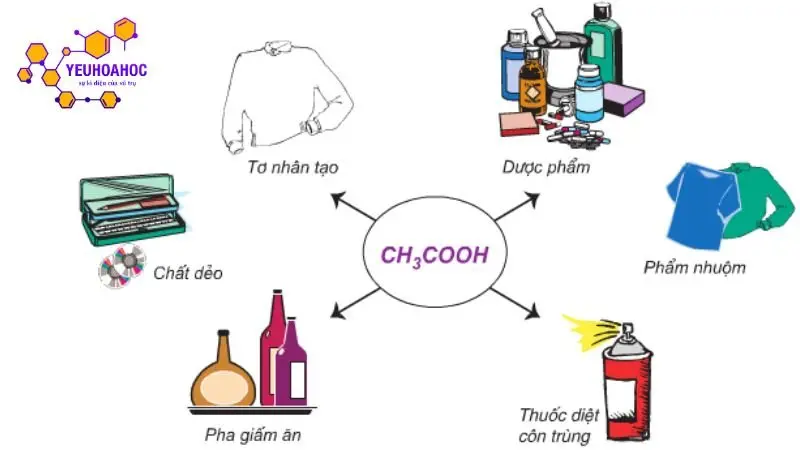
Trong công nghiệp
- Sản xuất dung môi:
- Axit acetic là dung môi phổ biến trong nhiều ngành công nghiệp, được sử dụng để hòa tan các hợp chất hữu cơ như sơn, keo, nhựa, v.v.
- Dung dịch axit acetic pha loãng cũng được sử dụng để tẩy rửa các bề mặt kim loại và nhựa.
- Sản xuất hóa chất:
- Axit acetic là nguyên liệu quan trọng để sản xuất nhiều hóa chất khác như vinyl axetat, cellulose acetate, axetanhydrit, v.v.
- Các hóa chất này được sử dụng trong nhiều ngành công nghiệp như dệt may, sơn phủ, dược phẩm, v.v.
- Dược phẩm:
- Axit acetic được sử dụng trong sản xuất một số loại thuốc như aspirin, ibuprofen, paracetamol, v.v.
- Axit acetic cũng được sử dụng như một dung môi để bào chế thuốc và như một chất khử trùng.
- Thực phẩm:
- Axit acetic là thành phần chính của giấm, được sử dụng để tạo vị chua cho thực phẩm và để bảo quản thực phẩm.
- Axit acetic cũng được sử dụng trong sản xuất một số loại thực phẩm khác như kẹo cao su, nước ngọt có ga, v.v.
- Nông nghiệp:
- Axit acetic được sử dụng để điều chỉnh độ pH của đất, giúp cây trồng hấp thu dinh dưỡng tốt hơn.
- Axit acetic cũng được sử dụng để sản xuất một số loại phân bón và thuốc trừ sâu.
Trong đời sống
- Vệ sinh nhà cửa:
- Dung dịch axit acetic pha loãng được sử dụng để tẩy rửa các bề mặt trong nhà như sàn nhà, bếp, nhà vệ sinh, v.v.
- Axit acetic cũng có hiệu quả trong việc khử mùi hôi và diệt khuẩn.
- Làm đẹp:
- Axit acetic được sử dụng trong một số sản phẩm chăm sóc da như toner, mặt nạ, v.v.
- Axit acetic giúp tẩy tế bào chết, làm sáng da và se khít lỗ chân lông.
- Bảo quản thực phẩm:
- Axit acetic được sử dụng để bảo quản một số loại thực phẩm như trái cây, rau quả, thịt, cá, v.v.
- Axit acetic giúp ức chế sự phát triển của vi khuẩn và nấm mốc, giúp thực phẩm tươi ngon lâu hơn.
Tác hại của axit acetic
Gây bỏng da:
- Axit acetic là một axit mạnh, có thể gây bỏng da nếu tiếp xúc trực tiếp. Mức độ bỏng phụ thuộc vào nồng độ axit acetic, thời gian tiếp xúc và vị trí tiếp xúc.
- Các triệu chứng bỏng da do axit acetic bao gồm: da đỏ, sưng tấy, rát bỏng, phồng rộp, bong tróc da, v.v.
- Trong trường hợp bỏng nặng, axit acetic có thể gây tổn thương sâu đến da, thậm chí có thể dẫn đến hoại tử da.
Gây tổn thương mắt:
- Axit acetic có thể gây tổn thương mắt nghiêm trọng nếu tiếp xúc trực tiếp.
- Các triệu chứng tổn thương mắt do axit acetic bao gồm: đau nhức mắt, chảy nước mắt, đỏ mắt, mờ mắt, tổn thương giác mạc, v.v.
- Trong trường hợp nghiêm trọng, axit acetic có thể dẫn đến mù lòa.
Gây ngộ độc khi nuốt phải:
- Nuốt phải axit acetic có thể gây ngộ độc nghiêm trọng, thậm chí có thể dẫn đến tử vong.
- Các triệu chứng ngộ độc axit acetic bao gồm: đau bụng, buồn nôn, nôn mửa, tiêu chảy, chảy máu dạ dày, khó thở, v.v.
- Trong trường hợp ngộ độc axit acetic, cần đưa nạn nhân đến cơ sở y tế ngay lập tức.
Gây ô nhiễm môi trường:
- Axit acetic nếu không được xử lý properly có thể gây ô nhiễm môi trường nước và đất.
- Axit acetic có thể làm giảm độ pH của nước, ảnh hưởng đến các sinh vật sống trong nước.
- Axit acetic cũng có thể làm thoái hóa đất, ảnh hưởng đến khả năng sinh trưởng của cây trồng.
Biện pháp an toàn khi sử dụng axit acetic
Sử dụng dụng cụ bảo hộ lao động:
- Khi sử dụng axit acetic, cần đeo găng tay, khẩu trang, kính bảo hộ và quần áo bảo hộ để bảo vệ bản thân khỏi tác hại của axit acetic.
- Găng tay nên được làm từ chất liệu chống hóa chất như cao su nitrile hoặc neoprene.
- Khẩu trang nên có bộ lọc khí để lọc hơi axit acetic.
- Kính bảo hộ nên có khả năng chống trầy xước và chống hóa chất.
- Quần áo bảo hộ nên được làm từ chất liệu chống thấm nước và axit.
Cẩn thận khi thao tác:
- Cần cẩn thận khi thao tác với axit acetic để tránh tiếp xúc trực tiếp với da, mắt hoặc quần áo.
- Nên sử dụng dụng cụ phù hợp để thao tác với axit acetic, ví dụ như phễu, bình thí nghiệm, v.v.
- Tránh làm đổ hoặc văng axit acetic.
- Sau khi sử dụng axit acetic, cần rửa tay sạch bằng xà phòng và nước.
Bảo quản axit acetic đúng cách:
- Axit acetic cần được bảo quản trong bình kín, có nhãn ghi rõ tên hóa chất và nồng độ.
- Bình đựng axit acetic cần được đặt ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và xa tầm tay trẻ em.
- Không được bảo quản axit acetic cùng với các chất dễ cháy nổ hoặc các chất oxy hóa mạnh.
Xử lý axit acetic thải đúng quy định:
- Axit acetic thải không được đổ trực tiếp ra môi trường.
- Cần xử lý axit acetic thải theo quy định của pháp luật về bảo vệ môi trường.
- Một số phương pháp xử lý axit acetic thải phổ biến bao gồm: trung hòa axit acetic bằng dung dịch kiềm, đốt axit acetic trong lò đốt chuyên dụng, xử lý sinh học axit acetic.
Một số bài tập áp dụng về axit acetic
Bài 1: Axit acetic là một axit yếu, có hằng số điện li \( K_a = 1.8 \times 10^{-5} \). Giả sử bạn có 500 mL dung dịch axit acetic 0.1 M.
Tính độ điện li (\(\alpha\)) của axit acetic trong dung dịch này
Độ điện li \(\alpha\) của axit acetic có thể được tính bằng cách giải phương trình cân bằng cho sự điện li:
\[ CH_3COOH \rightleftharpoons H^+ + CH_3COO^- \]
Với:
Phương trình cân bằng là:
\[ K_a = \frac{[H^+][CH_3COO^-]}{[CH_3COOH]} = \frac{(C\alpha)(C\alpha)}{C(1-\alpha)} = \frac{C\alpha^2}{1-\alpha} \]
Giải phương trình:
\[ 1.8 \times 10^{-5} = \frac{0.1\alpha^2}{1-\alpha} \]
Giả sử \(\alpha\) nhỏ, ta có thể bỏ qua \(\alpha\) ở mẫu số, và giải phương trình:
\[ \alpha \approx \sqrt{\frac{1.8 \times 10^{-5}}{0.1}} = \sqrt{1.8 \times 10^{-4}} \approx 0.0134 \]
Tính pH của dung dịch
\[ pH = -\log[H^+] = -\log(C\alpha) = -\log(0.1 \times 0.0134) \approx 2.87 \]
Tính nồng độ ion H+ và CH3COO-
\[ [H^+] = [CH_3COO^-] = C\alpha = 0.1 \times 0.0134 = 0.00134 \text{ M} \]
Bài 2: Bạn có 50 mL dung dịch axit acetic 0.1 M. Tính điểm tương đương khi thêm dung dịch NaOH 0.1 M và tính pH của dung dịch sau khi thêm 40 mL dung dịch NaOH 0.1 M.
Giải bài tập
Bước 1: Tính số mol axit acetic và NaOH.
Số mol axit acetic ban đầu:
\[
n_{\text{CH}_3\text{COOH}} = 0.1 \, \text{M} \times 0.050 \, \text{L} = 0.005 \, \text{mol}
\]
Số mol NaOH thêm vào:
\[
n_{\text{NaOH}} = 0.1 \, \text{M} \times 0.040 \, \text{L} = 0.004 \, \text{mol}
\]
Bước 2: Xác định phản ứng
Phản ứng trung hòa:
\[
\text{CH}_3\text{COOH} + \text{NaOH} \rightarrow \text{CH}_3\text{COONa} + \text{H}_2\text{O}
\]
Bước 3: Tính số mol các chất sau phản ứng.
Số mol axit acetic còn lại sau phản ứng:
\[
n_{\text{CH}_3\text{COOH, còn lại}} = 0.005 \, \text{mol} – 0.004 \, \text{mol} = 0.001 \, \text{mol}
\]
Số mol muối natri axetat tạo thành:
\[
n_{\text{CH}_3\text{COONa}} = 0.004 \, \text{mol}
\]
Bước 4: Tính pH của dung dịch.
Phương trình tính pH cho dung dịch đệm:
\[
pH = pK_a + \log \left(\frac{[\text{CH}_3\text{COO}^-]}{[\text{CH}_3\text{COOH}]}\right)
\]
Trong đó \( pK_a \approx 4.74 \) cho axit acetic.
\[ pH = 4.74 + \log \left(\frac{0.004}{0.001}\right) = 4.74 + 0.60 = 5.34 \]
Tóm lại, axit acetic là một hợp chất hữu cơ quan trọng với nhiều ứng dụng đa dạng trong đời sống và sản xuất. Việc sử dụng axit acetic một cách hiệu quả và an toàn sẽ góp phần mang lại nhiều lợi ích cho con người. Tuy nhiên, cần lưu ý đến những tác hại tiềm ẩn của axit acetic để đảm bảo an toàn cho bản thân và môi trường.







