Trong thế giới rộng lớn của bảng tuần hoàn, Thiếc (Sn) xuất hiện như một nguyên tố kim loại với một lịch sử phong phú và nhiều ứng dụng quan trọng trong đời sống cũng như công nghiệp. Từ việc sử dụng trong sản xuất hợp kim, bảo quản thực phẩm, đến các ứng dụng trong công nghệ cao, Thiếc không ngừng chứng tỏ vị thế không thể thay thế của mình trong nền kinh tế toàn cầu. Bài viết này yeuhoahoc.edu.vn sẽ đưa bạn qua một hành trình khám phá về Thiếc, từ nguồn gốc, cấu trúc, tính chất, đến những ứng dụng đặc biệt của nó.
Giới thiệu về nguyên tố Thiếc
Định Nghĩa
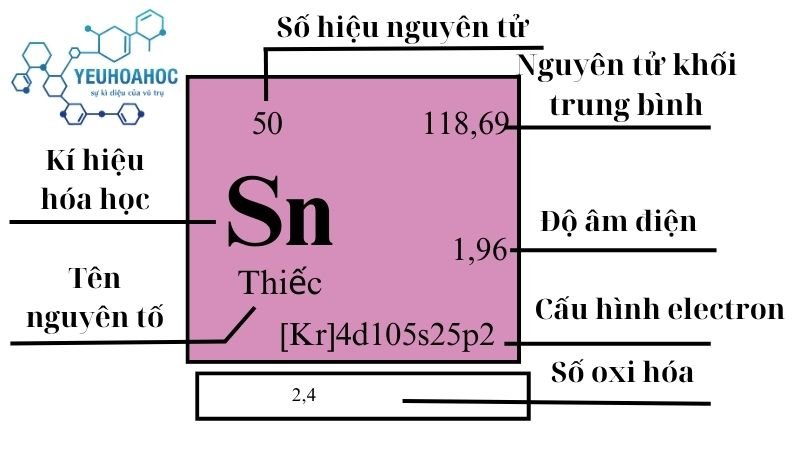
Nguyên tố Thiếc, với tên tiếng Anh là Tin và kí hiệu hóa học là Sn (từ Latinh “Stannum”), là một nguyên tố kim loại có mặt trong bảng tuần hoàn hóa học. Thiếc nằm trong nhóm 14 và sở hữu số hiệu nguyên tử 5. Nó nổi bật với khả năng chống gỉ, dễ dàng tạo thành hợp kim với nhiều kim loại khác và được sử dụng rộng rãi từ thời cổ đại.
Lịch sử hình thành nguyên tố Thiếc
- Thời kỳ đồ đồng: Thiếc được sử dụng từ thời kỳ đồ đồng (khoảng 3000 TCN) để tạo ra hợp kim đồng thau (hợp kim của đồng và thiếc).
- Thời cổ đại: Thiếc được sử dụng bởi người Ai Cập, Hy Lạp và La Mã để làm đồ trang sức, đồ dùng và vũ khí.
- Thời Trung Cổ: Thiếc được sử dụng để làm đồ hộp, đồ gốm và kính màu.
- Cách mạng công nghiệp: Nhu cầu về thiếc tăng cao trong Cách mạng công nghiệp để sản xuất đồ hộp và các sản phẩm khác.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 3000 TCN: Thiếc được sử dụng để tạo ra hợp kim đồng thau.
- 1200 TCN: Thiếc được khai thác ở Cornwall, Anh.
- 600 TCN: Thiếc được sử dụng để làm đồ gốm tráng men ở Hy Lạp.
- 1000 SCN: Thiếc được sử dụng để làm đồ hộp ở Trung Quốc.
- 1800 SCN: Nhu cầu về thiếc tăng cao trong Cách mạng công nghiệp.
Nguyên tố Thiếc trong bảng tuần hoàn hóa học
- Nhóm: 14 (nhóm cacbon)
- Chu kỳ: 5
- Cấu hình electron: [Kr] 4d10 5s2 5p2
- Khối lượng nguyên tử: 118,69 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 14 | 5 | 118,710(7) | 7,287 | 505,08 | 2875 | 0,228 | 1,96 | 2,3 |
Tính chất của nguyên tố Thiếc
Tính chất vật lý
- Màu sắc: Trắng bạc
- Trạng thái: Rắn ở nhiệt độ phòng
- Dạng tinh thể: Tetragonal
- Khối lượng riêng: 7,28 g/cm³
- Điểm nóng chảy: 231,9 °C
- Điểm sôi: 2270 °C
- Tính dẫn điện: Tốt
- Tính dẫn nhiệt: Tốt
- Độ dẻo: Dẻo
- Độ cứng: Thấp
- Độ bền kéo: Trung bình
- Khả năng chống ăn mòn: Tốt
Tính chất hóa học
- Tính khử: Yếu
- Số oxi hóa: +2, +4
- Tác dụng với axit:
- Tác dụng với axit HCl loãng:
Sn + 2HCl → SnCl₂ + H₂↑
- Tác dụng với axit H₂SO₄ đặc:
Sn + 2H₂SO₄ → SnO₂ + 2SO₂↑ + 2H₂O
- Tác dụng với bazơ:
- Tác dụng với NaOH:
Sn + 2NaOH → Na₂SnO₂ + H₂↑
- Tác dụng với dung dịch muối:
- Tác dụng với dung dịch CuSO₄:
Sn + CuSO₄ → SnSO₄ + Cu↓
- Tác dụng với oxy:
- Bị oxy hóa chậm trong không khí ẩm tạo thành lớp oxit mỏng bảo vệ kim loại bên trong.
- Tác dụng với halogen:
- Tác dụng với Cl₂:
Sn + Cl₂ → SnCl₄
Ứng dụng của nguyên tố Thiếc

Hợp kim
Thiếc là thành phần chính trong hợp kim đồng thau (hợp kim của đồng và thiếc), được sử dụng để làm đồ trang sức, nhạc cụ, tượng, và các vật dụng khác.
Thiếc cũng được sử dụng trong hợp kim hàn thiếc, dùng để hàn các mối nối giữa các kim loại khác nhau.
Thiếc cũng được sử dụng trong hợp kim babbitt, dùng để làm ổ trục quay trong các động cơ.
Đồ hộp
Thiếc được sử dụng để tráng lên thép để làm đồ hộp, giúp bảo quản thực phẩm khỏi bị hư hỏng.
Điện tử
Thiếc được sử dụng trong các linh kiện điện tử như tụ điện, điện trở và vi mạch.
Thiếc cũng được sử dụng trong hàn thiếc, dùng để kết nối các linh kiện điện tử trên bảng mạch.
Hóa chất
Thiếc được sử dụng trong các hợp chất hóa học như thiếc chloride và thiếc dioxide.
Thiếc chloride được sử dụng trong ngành dệt nhuộm và mạ điện.
Thiếc dioxide được sử dụng trong sản xuất gốm sứ và men sứ.
Ngoài ra, thiếc còn được sử dụng trong:
Sản xuất kính màu
Làm pin
Chế tạo nhạc cụ
Làm đồ trang sức
Sản xuất đồ chơi
Điều chế và sản xuất nguyên tố Thiếc
Điều chế
Điều chế Thiếc trong phòng thí nghiệm
Trong phòng thí nghiệm, thiếc thường được điều chế thông qua phản ứng giữa các hợp chất của thiếc. Một phương trình điều chế điển hình có thể như sau:
SnCl2 + 2Na → Sn + 2NaCl
Trong phản ứng này, chloride thiếc(II) (SnCl2) phản ứng với natri (Na) để tạo ra thiếc kim loại (Sn) và natri chloride (NaCl) làm sản phẩm phụ. Phản ứng này cần được thực hiện dưới điều kiện kiểm soát nghiêm ngặt vì nó liên quan đến việc sử dụng kim loại kiềm mạnh.
Điều chế Thiếc trong công nghiệp
Trên quy mô công nghiệp, thiếc chủ yếu được sản xuất từ quặng thiếc, với cassiterite (SnO2) là nguồn quặng quan trọng nhất. Quy trình điều chế thiếc từ quặng bao gồm các bước luyện quặng và tinh chế:
- Luyện Quặng: Cassiterite được nung chảy với than cốc trong lò cao để khử oxi và thu được thiếc thô.
- SnO2+2C→Sn+2CO
- Tinh Chế: Thiếc thô sau đó được tinh chế để loại bỏ tạp chất, thường thông qua quy trình điện phân hoặc dùng phương pháp luyện thăng.
Sản xuất
Sau khi điều chế, thiếc thô được chuyển đến các nhà máy để sản xuất thành các sản phẩm cuối cùng. Sản xuất thiếc có thể bao gồm việc đúc thành các thanh, dây, hoặc bột tùy thuộc vào nhu cầu của người sử dụng. Thiếc cũng thường được hợp kim hóa với các kim loại khác để tạo ra các hợp kim có tính chất mong muốn, như hợp kim thiếc-chì dùng trong hàn, hoặc hợp kim thiếc-đồng dùng trong sản xuất đồng thau.
Phản ứng của nguyên tố (cho ví dụ cụ thể)
Phản ứng với axit
- Thiếc tác dụng với axit HCl loãng:
Sn + 2HCl → SnCl₂ + H₂↑
- Thiếc tác dụng với axit H₂SO₄ đặc:
Sn + 2H₂SO₄ → SnO₂ + 2SO₂↑ + 2H₂O
Phản ứng với bazơ
- Thiếc tác dụng với NaOH:
Sn + 2NaOH → Na₂SnO₂ + H₂↑
Phản ứng với dung dịch muối
- Thiếc tác dụng với dung dịch CuSO₄:
Sn + CuSO₄ → SnSO₄ + Cu↓
Phản ứng với oxy
- Thiếc bị oxy hóa chậm trong không khí ẩm tạo thành lớp oxit mỏng bảo vệ kim loại bên trong.
Phản ứng với halogen
- Thiếc tác dụng với Cl₂:
Sn + Cl₂ → SnCl₄
Ví dụ cụ thể:
- Sử dụng thiếc để tráng lên thép để làm đồ hộp:
Đây là ứng dụng dựa trên tính chất chống ăn mòn tốt của thiếc. Thiếc sẽ tạo thành một lớp bảo vệ trên bề mặt thép, ngăn không cho thép tiếp xúc với oxy và nước, do đó giúp bảo quản thực phẩm bên trong không bị hư hỏng.
- Sử dụng thiếc trong hợp kim hàn thiếc:
Hợp kim hàn thiếc được sử dụng để kết nối các mối nối giữa các kim loại khác nhau. Thiếc có khả năng bám dính tốt trên nhiều kim loại khác nhau và có nhiệt độ nóng chảy thấp, do đó là thành phần quan trọng trong hợp kim hàn thiếc.
Vấn đề an toàn khi sử dụng nguyên tố Thiếc
Hít phải bụi thiếc

Hít phải bụi thiếc có thể gây ra các vấn đề về hô hấp, bao gồm:
- Viêm phế quản
- Viêm phổi
- Xơ phổi
Tiếp xúc với da
Tiếp xúc với da có thể gây ra kích ứng da, bao gồm:
- Ngứa
- Mẩn đỏ
- Viêm da
Nuốt phải thiếc
Nuốt phải thiếc có thể gây ra các vấn đề về tiêu hóa, bao gồm:
- Buồn nôn
- Nôn mửa
- Tiêu chảy
Cách bảo vệ bản thân khi sử dụng thiếc:
- Đeo khẩu trang khi làm việc với thiếc để tránh hít phải bụi thiếc.
- Mang găng tay khi làm việc với thiếc để tránh tiếp xúc với da.
- Rửa tay kỹ lưỡng sau khi làm việc với thiếc.
- Tránh ăn uống hoặc hút thuốc khi làm việc với thiếc.
Lưu ý:
- Những người có vấn đề về hô hấp hoặc da nên đặc biệt cẩn thận khi sử dụng thiếc.
- Phụ nữ mang thai và cho con bú nên tránh tiếp xúc với thiếc.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Thiếc mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Thiếc. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









