Với đặc tính siêu bền, chống ăn mòn và khả năng chịu nhiệt cao, Titanium không chỉ là vật liệu lý tưởng cho việc sản xuất máy bay và tàu vũ trụ mà còn được sử dụng rộng rãi trong ngành y học, đặc biệt là trong việc sản xuất các bộ phận cấy ghép và dụng cụ y tế. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về nguyên tố Titani, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Titani
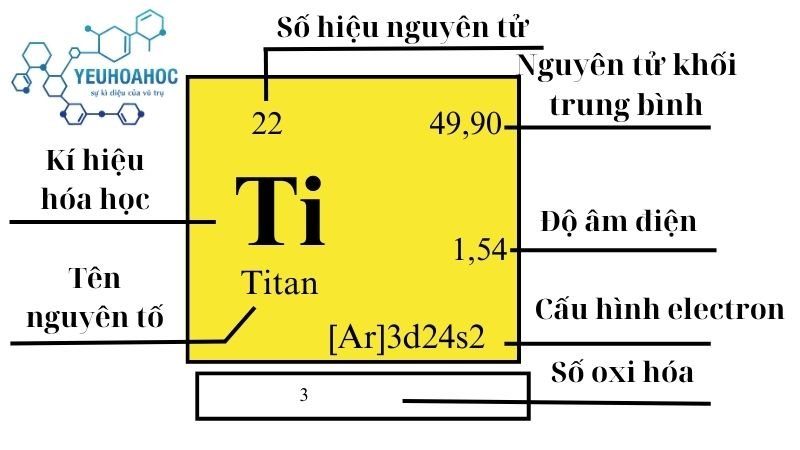
Định nghĩa
Titan (Ti) Titanium trong tiếng Anh, số hiệu nguyên tử là 22 – một nguyên tố hóa học thuộc nhóm kim loại chuyển tiếp trong bảng tuần hoàn hóa học. Với khả năng chống ăn mòn xuất sắc, trọng lượng nhẹ và độ bền vượt trội, Titan đã được xem như “kim loại của tương lai” với đa dạng ứng dụng quan trọng trong nhiều lĩnh vực khác nhau.
Lịch sử hình thành
Nguyên tố Titan được phát hiện vào cuối thế kỷ 18 nhưng mãi đến đầu thế kỷ 20, người ta mới bắt đầu khai thác và sử dụng rộng rãi nó trong các ngành công nghiệp khác nhau.
Dưới đây là một số mốc thời gian quan trọng trong lịch sử phát hiện ra Titani:
- Thế kỷ 18: William Gregor, nhà khoáng vật học người Anh, phát hiện ra một loại cát đen nặng ở Cornwall, Anh.
- 1795: Martin Heinrich Klaproth, nhà hóa học người Đức, xác định thành phần chính của cát đen là một nguyên tố mới và đặt tên nó là “Titan”, theo tên Titans – những vị thần khổng lồ trong thần thoại Hy Lạp.
- Thế kỷ 20: Kỹ thuật sản xuất Titan được phát triển, mở ra tiềm năng ứng dụng rộng rãi của kim loại này.
Nguyên tố Titani trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn, Titan được xếp vào nhóm 4, nơi tập trung các nguyên tố có tính chất tương đồng như độ cứng và độ bền cao.
- Thuộc nhóm 4, chu kỳ 4 trong bảng tuần hoàn.
- Số nguyên tử: 22
- Cấu hình electron: [Ar]3d24s2
- Khối lượng nguyên tử: 47,867 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 4 | 4 | 47,867(1) | 4,54 | 1941 | 3560 | 0,523 | 1,54 | 5650 |
Tính chất của nguyên tố Titani
Tính chất vật lý
- Màu sắc: Trắng bạc
- Trạng thái: Rắn
- Khối lượng riêng: 4,5 g/cm³
- Điểm nóng chảy: 1668 °C
- Điểm sôi: 3287 °C
- Độ bền: Cao, gấp 6 lần thép
- Tính dẻo dai: Dễ dàng gia công thành nhiều hình dạng khác nhau
- Khả năng chống ăn mòn: Tuyệt vời, có thể chống lại nước biển, axit và nhiều hóa chất khác
- Độ dẫn điện: Kém
- Độ dẫn nhiệt: Kém
Tính chất hóa học
- Hóa trị: +2, +3, +4
- Tính khử: Yếu
- Tính oxi hóa: Mạnh
- Tác dụng với axit:
- Tan trong axit nitric đặc, axit sunfuric đặc
- Không tan trong axit clohydric loãng
- Tác dụng với bazơ: Không tác dụng
- Tác dụng với dung dịch muối:
- Khử được một số ion kim loại như Fe²⁺, Cu²⁺
- Tác dụng với phi kim:
- Tác dụng với oxy ở nhiệt độ cao
- Tác dụng với nitơ ở nhiệt độ cao
- Tác dụng với clo ở nhiệt độ cao
Lưu ý:
- Titan có khả năng chống ăn mòn tuyệt vời do lớp oxit mỏng trên bề mặt kim loại. Lớp oxit này rất bền và có khả năng tự phục hồi nếu bị trầy xước.
- Titan là kim loại dẻo dai, dễ dàng gia công thành nhiều hình dạng khác nhau.
Ứng dụng của nguyên tố Titani

Nhờ những tính chất ưu việt như độ bền cao, khả năng chống ăn mòn tuyệt vời, trọng lượng nhẹ và dẻo dai, Titan được ứng dụng rộng rãi trong nhiều lĩnh vực quan trọng:
- Hàng không vũ trụ:
- Chế tạo máy bay, tàu vũ trụ, tên lửa nhờ độ bền cao, chịu nhiệt tốt và trọng lượng nhẹ.
- Ví dụ:
- Máy bay Boeing 787 Dreamliner sử dụng 15% Titan.
- Tàu con thoi Space Shuttle sử dụng 87% Titan.
- Y tế:
- Nhờ khả năng tương thích sinh học cao, Titan được sử dụng làm implant nha khoa, chốt xương, khớp nhân tạo…
- Ví dụ:
- Implant nha khoa Titan có thể tồn tại lâu dài trong cơ thể mà không bị đào thải.
- Khớp nhân tạo Titan giúp cải thiện chất lượng cuộc sống cho bệnh nhân bị thoái hóa khớp.
- Công nghiệp:
- Titan được ứng dụng trong sản xuất hóa chất, thiết bị năng lượng, xi mạ…
- Ví dụ:
- Bồn chứa hóa chất được làm từ Titan có khả năng chống ăn mòn cao.
- Trao đổi nhiệt trong các nhà máy điện được làm từ Titan có độ bền cao và chịu nhiệt tốt.
- Đồ thể thao:
- Gậy đánh golf, khung xe đạp, vợt tennis… sử dụng Titan vì độ bền và trọng lượng nhẹ.
- Ví dụ:
- Gậy đánh golf Titan giúp tăng tốc độ và độ chính xác cú đánh.
- Khung xe đạp Titan giúp giảm trọng lượng xe và tăng độ bền.
- Trang sức:
- Nhẫn, lắc tay, dây chuyền… làm từ Titan có độ bền cao, sáng bóng và không bị gỉ sét.
- Titan là một lựa chọn thay thế cho vàng và bạc trong ngành trang sức.
Ngoài ra, Titan còn được ứng dụng trong nhiều lĩnh vực khác như:
- Năng lượng: Ống dẫn khí đốt, pin nhiên liệu
- Môi trường: Xử lý nước thải, khử muối
- Quân sự: Xe bọc thép, tàu ngầm
- Điện tử: Linh kiện điện tử, vi mạch
Điều chế và sản xuất nguyên tố Titan
Điều chế
- Điều chế trong phòng thí nghiệm:
- Phương pháp khử Kroll:
- Khử TiCl4 bằng Mg trong bình kín.
- Phản ứng xảy ra ở nhiệt độ cao (800 – 900°C).
- Sản phẩm thu được là Ti dạng bột.
Chuyển đổi Ilmenite hoặc Rutile thành Tetrachloride Titan (TiCl₄): Đầu tiên, quặng Titan như ilmenite (FeTiO₃) hoặc rutile (TiO₂) được tinh chế và sau đó phản ứng với clorua ở nhiệt độ cao để tạo thành TiCl₄. Quá trình này thường đòi hỏi sự hiện diện của cacbon để loại bỏ sắt và oxy từ quặng.
Khử TiCl₄: TiCl₄ sau đó được khử bằng magiê hoặc natri trong một môi trường không có oxy để tạo ra Titan kim loại. Phản ứng khử này tạo ra Titan dạng bột, sau đó có thể được luyện chảy để tạo ra khối Titan.
- Điều chế trong công nghiệp:
- Phương pháp Kroll:
- Khử TiCl4 bằng Mg trong bình kín.
- Phản ứng xảy ra ở nhiệt độ cao (800 – 900°C).
- Sản phẩm thu được là Ti dạng xốp.
- Ti xốp được nung nóng trong chân không để loại bỏ Mg dư.
Chuẩn bị Tetrachloride Titan (TiCl₄): TiCl₄ được sản xuất từ quặng Titan thông qua quá trình clor hóa, tương tự như quá trình trong phòng thí nghiệm nhưng với công suất lớn hơn.
Khử TiCl₄: Trong quy mô công nghiệp, TiCl₄ được khử bằng magiê hoặc natri trong các lò khủng lớn để sản xuất Titan kim loại. Sản phẩm là khối Titan lớn, có thể được nung chảy và đúc thành các hình dạng cần thiết cho ứng dụng cụ thể.
Sản xuất
- Quá trình sản xuất Titan bao gồm các bước sau:
- Khai thác quặng Titan:
- Quặng Titan phổ biến nhất là ilmenit và rutil.
- Quặng được khai thác từ mỏ hoặc bãi cát ven biển.
- Luyện kim:
- Quặng Titan được nghiền nhỏ và xử lý bằng axit để chiết xuất TiCl4.
- TiCl4 được khử bằng Mg để tạo ra Ti dạng xốp.
- Ti xốp được nung nóng trong chân không để loại bỏ Mg dư.
- Gia công:
- Ti dạng xốp được nung chảy và đúc thành các hình dạng khác nhau như thanh, tấm, ống…
- Ti có thể được gia công bằng các phương pháp như cán, rèn, hàn…
- Khai thác quặng Titan:
Phản ứng của nguyên tố Titani

Phản ứng với Oxy
Khi tiếp xúc với oxy ở nhiệt độ cao, Titan phản ứng tạo thành oxit Titan (TiO₂), một hợp chất rắn trắng được sử dụng rộng rãi trong sản xuất sơn, mực in và các sản phẩm trắng khác.
Phản ứng:
Ti+O2→TiO2
Phản ứng với Nitơ
Ở nhiệt độ cao, Titan cũng có thể phản ứng với nitơ trong không khí để tạo thành nitrit Titan (TiN), một hợp chất cứng có màu vàng và được sử dụng như một lớp phủ bảo vệ cho các bộ phận máy móc.
Phản ứng:
Ti+N2→TiN2
3. Phản ứng với Axit Clohiđric
Titan phản ứng với axit clohiđric (HCl) để tạo thành tetraclorua Titan (TiCl₄) và giải phóng khí hydro. Phản ứng này thường được sử dụng trong quá trình điều chế Titan trong công nghiệp.
Phản ứng:
Ti+4HCl→TiCl4+2H2
4. Phản ứng với Axit Sunfuric
Khi phản ứng với axit sunfuric đặc, Titan tạo ra sulfat Titan và khí hydro. Đây là một phản ứng chậm và thường cần nhiệt độ cao để xảy ra.
Phản ứng:
Ti+H2SO4→TiSO4+H2
5. Phản ứng với Nước
Titan không phản ứng trực tiếp với nước ở điều kiện thường, nhưng ở nhiệt độ cao và áp suất cao, nó có thể phản ứng tạo ra hydro và oxit Titan.
Tồn tại và khai thác nguyên tố Titani
Nguyên tố Titan (Ti) là một trong những kim loại phổ biến nhất trên Trái Đất, được tìm thấy chủ yếu trong các khoáng vật như ilmenite (FeTiO₃) và rutile (TiO₂). Dưới đây là một cái nhìn tổng quan về sự tồn tại và cách khai thác nguyên tố Titan:
Sự tồn tại của Titani
Titan không tồn tại ở dạng nguyên tố tự do trong tự nhiên do nó dễ dàng kết hợp với oxy để tạo thành oxit. Các khoáng vật chứa Titan như ilmenite và rutile là nguồn cung cấp chính cho việc khai thác và sản xuất Titan. Những khoáng vật này thường được tìm thấy trong các lớp đất, cát, đá và được phân bố rộng rãi trên khắp thế giới.
Khai thác nguyên Tố Titani
Khai thác khoáng sản
Quá trình khai thác Titan bắt đầu từ việc tìm kiếm và khai thác các mỏ ilmenite và rutile. Các phương pháp khai thác bao gồm khai thác mỏ lộ thiên, khai thác dưới lòng đất và khai thác cát khoáng sản. Cát khoáng sản, chứa lượng lớn ilmenite và rutile, thường được khai thác từ các bãi biển và đồng bằng cát ven biển.
Tách và tinh chế khoáng sản
Sau khi khai thác, quá trình tinh chế bắt đầu bằng cách loại bỏ các tạp chất từ quặng thông qua các phương pháp như luyện cát, tách từ và tách nổi. Mục tiêu là tách khoáng vật Titan ra khỏi cát và các khoáng vật khác để thu được ilmenite hoặc rutile tinh khiết.
Chuyển đổi khoáng sản thành Titan
Khoáng vật Titan sau đó được chuyển đổi thành các hợp chất Titan sử dụng trong công nghiệp, chủ yếu qua quá trình xử lý hóa học. Ilmenite thường được xử lý trong quá trình chảy lò cao để tạo ra sắt và slag chứa tiotan. Rutile có thể được sử dụng trực tiếp hoặc sau khi tinh chế để sản xuất dioxide titan thông qua quá trình xử lý hóa học.
Vấn đề an toàn khi sử dụng nguyên tố Titani
Bụi Titani
- Hít phải bụi Titani có thể gây kích ứng phổi, dẫn đến các triệu chứng như ho, khó thở, tức ngực.
- Nguy cơ cao hơn đối với người có bệnh lý hô hấp như hen suyễn.
- Cần sử dụng biện pháp bảo hộ như khẩu trang khi làm việc với bụi Titani.
Bột Titani
- Bột Titani có thể gây nổ nếu tiếp xúc với lửa hoặc tia lửa.
- Cần lưu ý an toàn khi xử lý và bảo quản bột Titani.
Hợp chất Titani
- Một số hợp chất Titani có thể gây độc hại, ví dụ như tetrachloride Titani.
- Cần cẩn thận khi sử dụng các hợp chất Titani và tuân thủ hướng dẫn an toàn.
Dị ứng Titani
- Một số trường hợp hiếm gặp có thể bị dị ứng với Titani, dẫn đến các triệu chứng như ngứa, phát ban da.
- Cần theo dõi và báo cho bác sĩ nếu có bất kỳ dấu hiệu dị ứng nào.
Để đảm bảo an toàn khi sử dụng nguyên tố Titani, cần lưu ý những điểm sau:
- Sử dụng biện pháp bảo hộ cá nhân phù hợp như khẩu trang, găng tay, kính bảo hộ khi làm việc với Titani.
- Tuân thủ các quy định an toàn trong môi trường làm việc.
- Đọc kỹ hướng dẫn sử dụng và bảo quản trước khi sử dụng các sản phẩm có chứa Titani.
- Tránh tiếp xúc trực tiếp với bụi, bột và hợp chất Titani.
- Báo cho bác sĩ nếu có bất kỳ dấu hiệu bất thường nào sau khi sử dụng Titani.
Chất lượng và phương thức cung cấp nguyên tố Titani
Chất lượng
- Nguyên tố Titani có thể được tìm thấy ở nhiều dạng khác nhau, bao gồm quặng, xỉ, và kim loại.
- Chất lượng của Titani được đánh giá dựa trên độ tinh khiết và hàm lượng tạp chất.
- Titani có độ tinh khiết cao (99,9% trở lên) được sử dụng trong các ứng dụng đòi hỏi độ bền cao và khả năng chống ăn mòn tốt, như trong ngành hàng không vũ trụ và y tế.
- Titani có độ tinh khiết thấp hơn (90-99%) được sử dụng trong các ứng dụng thông thường hơn, như trong ngành xây dựng và công nghiệp.
Phương thức cung cấp
- Titani được cung cấp bởi các nhà sản xuất và nhà cung cấp kim loại trên toàn thế giới.
- Các phương thức cung cấp phổ biến bao gồm:
- Quặng Titani: được khai thác từ các mỏ quặng trên thế giới.
- Xỉ Titani: là sản phẩm phụ của quá trình sản xuất thép.
- Kim loại Titani: được sản xuất từ quặng hoặc xỉ Titani.
- Hợp kim Titani: được tạo ra bằng cách kết hợp Titani với các kim loại khác để cải thiện các tính chất của nó.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Titani mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Titani. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









