Nguyên tố kali, với ký hiệu hóa học là K và số nguyên tử là 19 trong bảng tuần hoàn, là một kim loại kiềm quan trọng đồng thời cũng là là một nguyên tố cần thiết cho sự phát triển của cây trồng và thúc đẩy sự hoạt động của các tế bào trong cơ thể con người. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về Kali, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Kali
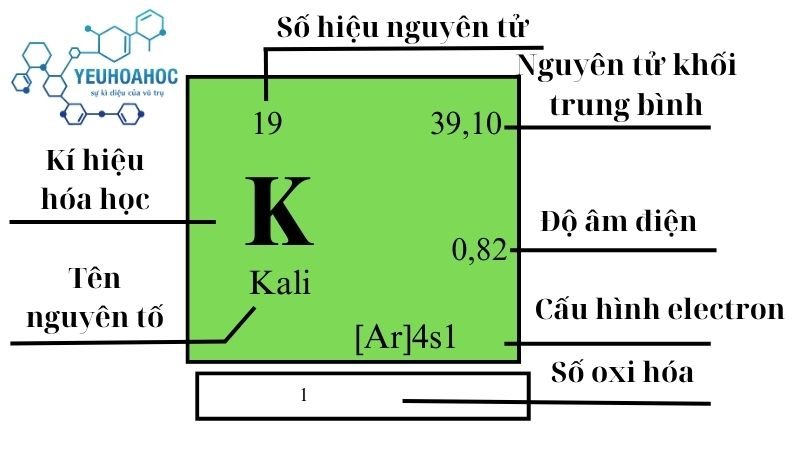
Định nghĩa nguyên tố kali
Kali, tên gọi trong tiếng anh là Potassium – một nguyên tố hóa học với ký hiệu K và số nguyên tử 19. Là một phần của nhóm kim loại kiềm trong bảng tuần hoàn, Kali nổi bật với đặc tính hóa học rất hoạt động, đặc biệt khi tiếp xúc với nước.
Số nguyên tử: 19
Cấu hình electron: 1s²2s²2p⁶3s²3p⁶4s¹
Khối lượng nguyên tử: 39,0983 u
Lịch sử hình thành nguyên tố Kali
Kali được phát hiện bởi Sir Humphry Davy vào năm 1807 thông qua quá trình điện phân kali hydroxide (KOH). Đây là một trong những kim loại kiềm đầu tiên được cô lập, đánh dấu một bước tiến quan trọng trong lĩnh vực hóa học.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1700: Antoine Lavoisier đề xuất tên gọi “kali” cho nguyên tố này.
- 1807: Sir Humphry Davy điện phân kali hydroxide để thu được kim loại kali.
- 1861: Robert Bunsen và Gustav Kirchhoff phát hiện ra vạch quang phổ đặc trưng của kali.
- 1920: Fritz Haber phát triển phương pháp tổng hợp amoniac từ nitơ và hydro, giúp tăng cường sản xuất phân bón kali.
- Thế kỷ 20: Kali được sử dụng rộng rãi trong nhiều lĩnh vực như nông nghiệp, công nghiệp và y tế.
Tầm quan trọng trong đời sống
Kali đóng một vai trò không thể thiếu trong cơ thể sống, đặc biệt là trong việc duy trì chức năng của tế bào, dẫn truyền thần kinh và co bóp cơ. Ngoài ra, kali cũng rất quan trọng trong nông nghiệp, đặc biệt là trong việc sản xuất phân bón.
Nguyên tố Kali trong bảng tuần hoàn hóa học
Thuộc nhóm 1 của bảng tuần hoàn, Kali chia sẻ những đặc tính chung của kim loại kiềm, bao gồm độ mềm, màu bạc sáng, và khả năng phản ứng hóa học mạnh mẽ, đặc biệt là với nước
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 1 | 4 | 39,0983(1) | 0,862 | 336,53 | 1032 | 0,757 | 0,82 | 20900 |
Tính chất của nguyên tố Kali
Tính chất vật lý
- Trạng thái: Chất rắn, màu trắng bạc
- Khối lượng riêng: 0,86 g/cm³
- Nhiệt độ nóng chảy: 63,5 °C
- Nhiệt độ sôi: 760 °C
- Độ cứng: 0,4 Mohs
- Tính dẫn điện: Tốt
- Tính dẫn nhiệt: Tốt
Tính chất hóa học
- Tính khử: Kali là kim loại có tính khử mạnh
- Phản ứng với nước: Kali phản ứng mãnh liệt với nước tạo thành dung dịch kiềm và khí hydro
- Phản ứng với axit: Kali phản ứng với axit tạo thành muối
- Phản ứng với oxy: Kali phản ứng với oxy tạo thành oxit
- Phản ứng với halogen: Kali phản ứng với halogen tạo thành muối halide
Một số lưu ý:
- Kali là kim loại hoạt động mạnh nên cần bảo quản trong dầu hỏa hoặc dầu parafin.
- Kali phản ứng mãnh liệt với nước nên cần cẩn thận khi sử dụng.
Ứng dụng của nguyên tố Kali

Kali là một nguyên tố quan trọng có nhiều ứng dụng trong các lĩnh vực khác nhau:
Nông nghiệp:
- Phân bón: Kali là một trong ba nguyên tố dinh dưỡng chính (NKP) cho cây trồng. Nó giúp cây phát triển khỏe mạnh, tăng năng suất và chống chịu sâu bệnh.
- Thức ăn gia súc: Kali được bổ sung vào thức ăn gia súc để giúp gia súc phát triển khỏe mạnh và tăng năng suất sữa.
Công nghiệp:
- Hóa chất: Kali được sử dụng để sản xuất xà phòng, thủy tinh, phân bón, thuốc men và nhiều sản phẩm khác.
- Kim loại: Kali được sử dụng để sản xuất pin, pin nhiên liệu và các hợp kim.
- Dệt may: Kali được sử dụng để sản xuất sợi và vải.
Y tế:
- Điều trị bệnh: Kali được sử dụng để điều trị các bệnh như cao huyết áp, rối loạn nhịp tim và suy tim.
- Bổ sung dinh dưỡng: Kali được bổ sung cho những người thiếu kali do chế độ ăn uống hoặc do các bệnh lý khác nhau.
Ngoài ra, Kali còn được sử dụng trong các lĩnh vực khác như:
- Lọc nước: Kali được sử dụng để loại bỏ các tạp chất khỏi nước.
- Bảo quản thực phẩm: Kali được sử dụng để bảo quản thực phẩm bằng cách ngăn ngừa sự phát triển của vi khuẩn.
- Năng lượng: Kali được sử dụng để sản xuất pin nhiên liệu.
Điều chế và sản xuất nguyên tố Kali
Điều chế
Điều chế trong phòng thí nghiệm:
- Điện phân dung dịch kali hydroxide: Đây là phương pháp phổ biến nhất để điều chế kali trong phòng thí nghiệm.
- Khử kali hydroxit bằng kim loại mạnh: Ví dụ như natri hoặc canxi.
- Nhiệt phân kali nitrat: Phương pháp này chỉ được sử dụng để điều chế lượng nhỏ kali.
Điều chế trong công nghiệp:
- Điện phân khoáng sản carnallite: Đây là phương pháp phổ biến nhất để điều chế kali trong công nghiệp.
- Khử kali hydroxit bằng hydro: Phương pháp này được sử dụng để điều chế kali có độ tinh khiết cao.
Sản xuất
- Kali được sản xuất mainly từ khoáng sản carnallite.
- Carnallite là một loại muối khoáng có chứa kali chloride, magie chloride và nước.
- Để sản xuất kali, carnallite được khai thác và nghiền thành bột mịn.
- Bột carnallite sau đó được hòa tan trong nước và được lọc để loại bỏ tạp chất.
- Dung dịch carnallite tinh khiết sau đó được điện phân để tạo ra kali và khí Clo.
- Kali được thu thập và đóng gói để bán.
Phản ứng của nguyên tố Kali

Kali là một kim loại hoạt động mạnh, do đó nó có thể phản ứng với nhiều chất khác nhau
- Nguyên tố kali phản ứng với nước:
- Kali phản ứng mãnh liệt với nước tạo thành dung dịch kali hydroxit (KOH) và khí hydro (H2).
- Phản ứng này tỏa ra nhiều nhiệt và có thể gây bỏng.
- 2K + 2H2O → 2KOH + H2
- Phản ứng với axit:
- Kali phản ứng với axit tạo thành muối và khí hydro.
- Ví dụ:
- 2K + 2HCl → 2KCl + H2
- 2K + H2SO4 → K2SO4 + H2
- Phản ứng với oxy:
- Kali phản ứng với oxy tạo thành kali oxit (K2O).
- Phản ứng này tỏa ra nhiệt.
- 4K + O2 → 2K2O
- Phản ứng với halogen:
- Kali phản ứng với halogen tạo thành muối halide.
- Ví dụ:
- 2K + Cl2 → 2KCl
- 2K + Br2 → 2KBr
- Phản ứng với một số kim loại khác:
- Kali phản ứng với một số kim loại khác tạo thành hợp kim.
Tồn tại và khai thác nguyên tố Kali
Tồn tại
- Kali đứng ở vị trí thứ 7 trong danh sách các nguyên tố phổ biến trong vỏ Trái Đất.
- Nó không tồn tại ở dạng tự do trong tự nhiên mà tồn tại dưới dạng các hợp chất, chủ yếu là khoáng chất.
- Một số khoáng chất chứa kali phổ biến bao gồm:
- Carnallite (KCl·MgCl2·6H2O)
- Sylvite (KCl)
- Kainite (KCl·MgSO4·3H2O)
- Langbeinite (K2SO4·2MgSO4)
Khai thác
- Kali được khai thác từ các mỏ khoáng sản.
- Các kỹ thuật khai thác thông dụng bao gồm
- Khai thác lộ thiên
- Khai thác ngầm
- Sau khi khai thác, quặng kali được nghiền thành bột mịn và được xử lý bằng các phương pháp hóa học để chiết xuất kali.
- Các phương pháp chiết xuất phổ biến bao gồm:
- Kết tinh
- Điện phân
- Sục khí
Vấn đề an toàn khi sử dụng nguyên tố Kali
- Tính hoạt động mạnh:
- Kali là kim loại hoạt động mạnh, dễ phản ứng với nước và oxy.
- Khi phản ứng với nước, kali tạo thành dung dịch kali hydroxit (KOH) có tính kiềm mạnh, có thể gây bỏng da.
- Khi phản ứng với oxy, kali có thể bốc cháy.
- Độc tính:
- Kali có thể gây ngộ độc nếu nuốt phải.
- Các triệu chứng ngộ độc kali bao gồm buồn nôn, nôn mửa, tiêu chảy, yếu cơ, tê liệt và tim đập nhanh.
- Trong trường hợp nghiêm trọng, ngộ độc kali có thể dẫn đến tử vong.
- Nguy cơ cháy nổ:
- Bột kali có thể phát nổ nếu tiếp xúc với lửa hoặc tia lửa.
- Do đó, cần cẩn thận khi sử dụng và bảo quản kali.
Để đảm bảo an toàn khi sử dụng nguyên tố Kali, cần lưu ý một số biện pháp sau:
- Bảo quản kali trong hộp kín, tránh tiếp xúc với nước và oxy.
- Khi sử dụng kali, cần đeo găng tay, kính bảo hộ và quần áo bảo hộ.
- Tránh để kali tiếp xúc với da và mắt.
- Nếu nuốt phải kali, cần rửa miệng ngay lập tức và đến gặp bác sĩ.
- Cẩn thận khi sử dụng kali gần lửa hoặc tia lửa.
Chất lượng và phương thức cung cấp nguyên tố Kali

Chất lượng và phương thức cung cấp nguyên tố Kali đóng vai trò quan trọng trong việc đảm bảo hiệu quả và an toàn cho các ứng dụng cụ thể. Dưới đây là một số điểm chính liên quan đến chất lượng và phương thức cung cấp Kali:
Chất lượng
- Tính tinh khiết:
- Chất lượng Kali phụ thuộc lớn vào độ tinh khiết của nó. Trong ứng dụng công nghiệp và khoa học, Kali có độ tinh khiết cao thường được yêu cầu để đảm bảo hiệu quả phản ứng và tránh tạp chất gây ảnh hưởng tiêu cực.
- Dạng cung cấp:
- Kali có thể được cung cấp dưới dạng kim loại mềm, bột, hoặc trong các hợp chất như kali hydroxide (KOH), kali clorua (KCl), kali nitrat (KNO₃), tùy thuộc vào nhu cầu sử dụng cụ thể.
Phương thức cung cấp
- Dạng kim loại:
- Kali kim loại thường được bảo quản dưới dạng bảo quản dầu khoáng hoặc trong môi trường khí trơ để ngăn chặn phản ứng với không khí hoặc hơi ẩm.
- Dạng hợp chất:
- Các hợp chất của Kali như KCl và KOH được cung cấp dưới dạng bột hoặc dung dịch, phù hợp cho nông nghiệp (phân bón), công nghiệp hóa chất, và nhiều ứng dụng khác.
- Vận chuyển và lưu trữ:
- Vận chuyển Kali, đặc biệt là dưới dạng kim loại, cần phải tuân thủ các quy định an toàn chặt chẽ để ngăn chặn nguy cơ cháy nổ. Lưu trữ cũng cần được thực hiện trong điều kiện kiểm soát phù hợp.
- Nhà cung cấp:
- Việc chọn lựa nhà cung cấp uy tín có khả năng cung cấp Kali với độ tinh khiết và dạng phù hợp là rất quan trọng. Đối với các ứng dụng cụ thể, việc kiểm định chất lượng từ phía nhà cung cấp là bước không thể bỏ qua.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Kali mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Kali. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









