Lưu huỳnh, ký hiệu hóa học S, số nguyên tử 16, là một nguyên tố không thể thiếu trong cuộc sống hàng ngày và ngành công nghiệp. Từ lịch sử hình thành đến các ứng dụng hiện đại, lưu huỳnh luôn có một vị trí đặc biệt trong bảng tuần hoàn hóa học. Bài viết này yeuhoahoc.edu.vn sẽ giới thiệu về nguyên tố Lưu huỳnh, bao gồm lịch sử, tính chất, ứng dụng, và các vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Lưu huỳnh
Định Nghĩa
Lưu huỳnh là một nguyên tố hóa học tự nhiên, được biết đến với màu vàng đặc trưng và khả năng cháy với ngọn lửa xanh. Nó chủ yếu được tìm thấy trong các hợp chất và khoáng vật.
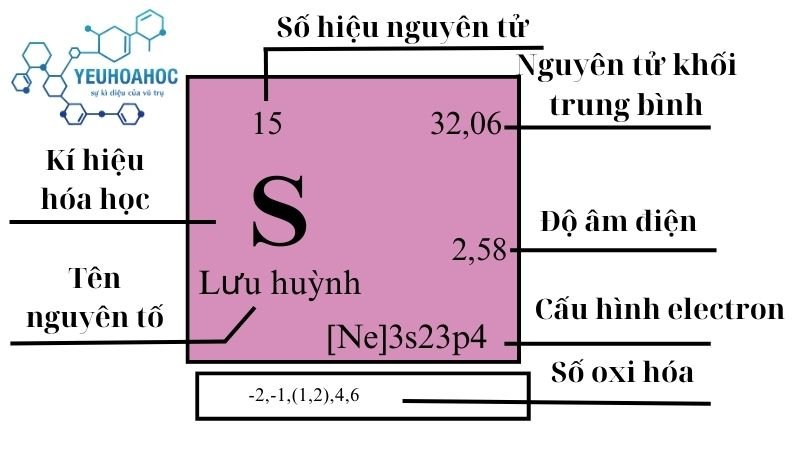
Tên tiếng Anh: Sulfur
Ký hiệu: S
Số hiệu nguyên tử: 16
Số electron lớp ngoài cùng: 6
Lịch sử hình thành nguyên tố Lưu huỳnh
Lưu huỳnh được biết đến từ thời cổ đại, với các bằng chứng sử dụng trong luyện kim và y học.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- Thời cổ đại:
- Lưu huỳnh được sử dụng để khử trùng, tẩy trắng và sản xuất thuốc nhuộm.
- Người ta biết đến lưu huỳnh từ thời cổ đại, được sử dụng trong các nghi lễ tôn giáo và y học.
- Thế kỷ 13:
- Nhà giả kim thuật người Ả Rập Jabir ibn Hayyan (Geber) đã mô tả chi tiết về việc chiết xuất lưu huỳnh từ quặng.
- Thế kỷ 18:
- Antoine Lavoisier xác định lưu huỳnh là một nguyên tố hóa học.
- Thế kỷ 19:
- Các nhà khoa học bắt đầu nghiên cứu các hợp chất của lưu huỳnh, bao gồm axit sulfuric, một trong những hóa chất quan trọng nhất trong công nghiệp.
Nguyên tố Lưu huỳnh trong bảng tuần hoàn hóa học
- Thuộc nhóm VIA (chủ nhóm 16) trong bảng tuần hoàn.
- Là nguyên tố phi kim.
- Nằm ở chu kỳ 3.
- Có 4 lớp electron.
- Cấu hình electron: 1s2 2s2 2p6 3s2 3p4.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 16 | 3 | 32,062 4 9 | 2,067 | 388,36 | 717,87 | 0,71 | 2,58 | 350 |
Tính chất của nguyên tố Lưu huỳnh
Tính chất vật lý
- Trạng thái: Chất rắn, màu vàng nhạt, không mùi, không vị.
- Dạng thù hình:
- Lưu huỳnh tà phương (Sα): Chất rắn màu vàng chanh, giòn, tan trong CS2.
- Lưu huỳnh đơn tà (Sβ): Chất rắn màu vàng, mềm, tan trong CS2.
- Nhiệt độ nóng chảy: 119 °C.
- Nhiệt độ sôi: 444,6 °C.
- Tỉ khối: 2,07 g/cm³.
- Tính dẫn điện, dẫn nhiệt: Kém.
Tính chất hóa học
- Tính oxi hóa:
- Tính oxi hóa của Lưu huỳnh được thể hiện khi tác dụng với kim loại, phi kim loại.
- Ví dụ:
- S + Mg → MgS
- S + O2 → SO2
- Tính khử:
- Lưu huỳnh thể hiện tính khử khi tác dụng với axit nitric đặc, axit sunfuric đặc.
- Ví dụ:
- S + 6HNO3 (đặc) → H2SO4 + 6NO2 + 2H2O
- S + 2H2SO4 (đặc) → 3SO2 + 2H2O
- Tác dụng với dung dịch kiềm:
- Tác dụng với dung dịch NaOH tạo thành muối Na2S và H2S.
- Ví dụ:
- S + 2NaOH → Na2S + H2O
- S + 2NaOH + H2O → Na2S + H2S
- Tác dụng với axit:
- Tác dụng với axit HCl tạo thành khí H2S.
- Ví dụ:
- S + 2HCl → H2S + Cl2
- Tác dụng với halogen:
- Tác dụng với Cl2 tạo thành S2Cl2.
- Ví dụ:
- S + Cl2 → S2Cl2
Lưu ý:
- Lưu huỳnh là nguyên tố hóa học có nhiều mức oxi hóa khác nhau (-2, +4, +6).
- Lưu huỳnh có thể tác dụng với nhiều kim loại, phi kim loại, axit, halogen.
Ứng dụng của nguyên tố Lưu huỳnh
Nông nghiệp
Sản xuất phân bón:
- Phân lân: Lưu huỳnh là thành phần quan trọng của phân lân, cung cấp dinh dưỡng cho cây trồng.
- Phân sunfat amoni: Lưu huỳnh được sử dụng để sản xuất amoniac, nguyên liệu cho phân sunfat amoni.
Sản xuất thuốc trừ sâu:
- Lưu huỳnh được sử dụng để sản xuất các loại thuốc trừ sâu như lưu huỳnh bột, lưu huỳnh vôi.
Công nghiệp
- Sản xuất axit sulfuric:
- Axit sulfuric là một trong những hóa chất quan trọng nhất trong công nghiệp.
- Lưu huỳnh là nguyên liệu chính được dùng để sản xuất axit sulfuric.
- Sản xuất cao su:
- Lưu huỳnh được sử dụng để lưu hóa cao su, giúp tăng độ bền và tính đàn hồi của cao su.
- Sản xuất thuốc nhuộm:
- Lưu huỳnh được sử dụng để sản xuất một số loại thuốc nhuộm.
Y học
- Chữa các bệnh về da:
- Lưu huỳnh được sử dụng để chữa các bệnh về da như ghẻ, nấm da.
- Chữa các bệnh về hô hấp:
- Lưu huỳnh được sử dụng để chữa các bệnh về hô hấp như viêm phế quản, hen suyễn.
Lĩnh vực khác
- Sản xuất diêm:
- Lưu huỳnh là thành phần chính của đầu que diêm.
- Sản xuất thực phẩm:
- Lưu huỳnh được sử dụng để bảo quản thực phẩm.
- Sản xuất dệt may:
- Lưu huỳnh được sử dụng để nhuộm màu vải.
Điều chế và sản xuất nguyên tố Lưu huỳnh

Điều chế
- Điều chế trong phòng thí nghiệm:
- Dựa vào tính khử của H2S:
- Cho khí H2S tác dụng với dung dịch SO2.
- 2H2S + SO2 → 3S + 2H2O
- Dựa vào tính oxi hóa của H2SO4:
- Để kim loại phản ứng với dung dịch axit sunfuric đặc, ở nhiệt độ cao..
- Ví dụ:
- Cu + 2H2SO4 (đặc) → CuSO4 + SO2 + 2H2O
- 2Fe + 6H2SO4 (đặc) → Fe2(SO4)3 + 3SO2 + 6H2O
- Điều chế trong công nghiệp:
- Phương pháp Frasch:
- Khai thác lưu huỳnh từ mỏ bằng cách nung nóng nước và khí nén.
- Phương pháp Claus:
- Khử SO2 thành S bằng khí H2S.
- 2H2S + SO2 → 3S + 2H2O
Sản xuất
- Lưu huỳnh được sản xuất chủ yếu từ mỏ quặng lưu huỳnh.
- Ngoài ra, lưu huỳnh cũng có thể được sản xuất từ khí đốt tự nhiên và khí mỏ.
- Sản xuất lưu huỳnh bao gồm các bước sau:
- Khai thác mỏ quặng lưu huỳnh.
- Nghiền nhỏ quặng lưu huỳnh.
- Nung nóng quặng lưu huỳnh để thu được lưu huỳnh nóng chảy.
- Làm nguội lưu huỳnh nóng chảy để thu được lưu huỳnh rắn.
Phản ứng của nguyên tố Lưu huỳnh
Phản ứng với kim loại:
- Lưu huỳnh tác dụng với hầu hết các kim loại tạo thành muối sunfua.
- Ví dụ:
- Mg + S → MgS
- 2Fe + S → Fe2S3
Phản ứng với phi kim loại:
- Lưu huỳnh tác dụng với một số phi kim loại như oxi, clo, flo.
- Ví dụ:
- S + O2 → SO2
- S + Cl2 → S2Cl2
- S + 3F2 → SF6
Phản ứng với axit:
- Lưu huỳnh tác dụng với axit nitric đặc, nóng tạo thành axit sulfuric.
- S + 6HNO3 (đặc) → H2SO4 + 6NO2 + 2H2O
Phản ứng với dung dịch kiềm:
- Lưu huỳnh tác dụng với dung dịch NaOH tạo thành muối Na2S và H2S.
- S + 2NaOH → Na2S + H2O
- S + 2NaOH + H2O → Na2S + H2S
Ngoài ra, lưu huỳnh còn có một số phản ứng khác như:
- Phản ứng cháy:
- S + O2 → SO2
- S + 3O2 → SO3
- Phản ứng khử:
- SO2 + 2H2S → 3S + 2H2O
- SO3 + H2S → S + H2O + SO2
Tồn tại và khai thác nguyên tố Lưu huỳnh
Tồn tại
- Lưu huỳnh là nguyên tố phổ biến thứ 16 trong vỏ Trái đất.
- Nó tồn tại dưới dạng tự nhiên trong các khoáng chất như quặng lưu huỳnh, thạch cao, và sunfat.
- Lưu huỳnh cũng có thể được tìm thấy trong các hợp chất hữu cơ như protein và axit amin.
Khai thác
- Lưu huỳnh được khai thác từ các mỏ quặng lưu huỳnh.
- Có hai phương pháp khai thác chính:
- Phương pháp Frasch:
- Khai thác lưu huỳnh từ mỏ bằng cách nung nóng nước và khí nén.
- Phương pháp này được sử dụng để khai thác lưu huỳnh ở độ sâu lớn.
- Phương pháp khai thác lộ thiên:
- Khai thác lưu huỳnh từ mỏ bằng cách đào hầm và sử dụng máy móc.
- Phương pháp này được sử dụng để khai thác lưu huỳnh ở độ sâu nông.
- Phương pháp Frasch:
Vấn đề an toàn khi sử dụng nguyên tố Lưu huỳnh
Độc tính
- Lưu huỳnh có thể gây kích ứng da, mắt, và hệ hô hấp.
- Hít phải khí lưu huỳnh có thể dẫn đến ho, khó thở, và viêm phế quản.
- Nuốt phải lưu huỳnh có thể dẫn đến buồn nôn, nôn mửa, và tiêu chảy.
Cháy nổ
- Lưu huỳnh là chất dễ cháy.
- Bụi lưu huỳnh có thể tạo thành hỗn hợp dễ nổ với không khí.
- Cần cẩn thận khi sử dụng lưu huỳnh gần lửa hoặc nguồn nhiệt.
Ô nhiễm môi trường
- Lưu huỳnh có thể gây ô nhiễm môi trường nước và không khí.
- Khí SO2 do lưu huỳnh thải ra có thể gây ra mưa axit.
Để đảm bảo an toàn khi sử dụng lưu huỳnh, cần thực hiện một số biện pháp sau:
- Sử dụng thiết bị bảo hộ cá nhân như găng tay, khẩu trang, và kính bảo hộ khi tiếp xúc với lưu huỳnh.
- Làm việc ở nơi thông gió tốt.
- Bảo quản lưu huỳnh ở nơi khô ráo, thoáng mát, tránh xa lửa và nguồn nhiệt.
- Cần phải tuân thủ các quy định về an toàn hóa chất.
Chất lượng và phương thức cung cấp nguyên tố
Chất lượng nguyên tố
- Độ tinh khiết: Nguyên tố có thể được cung cấp ở nhiều độ tinh khiết khác nhau, từ tinh khiết cao (99,99%+) đến kỹ thuật (95-99%). Độ tinh khiết ảnh hưởng đến giá cả và ứng dụng của nguyên tố.
- Đặc điểm kỹ thuật: Các đặc điểm kỹ thuật khác như kích thước hạt, hình dạng, độ đồng nhất cũng có thể ảnh hưởng đến chất lượng của nguyên tố.
Phương thức cung cấp nguyên tố
- Dạng thức: Nguyên tố có thể được cung cấp ở dạng rắn, lỏng hoặc khí.
- Quy cách đóng gói: Nguyên tố có thể được đóng gói trong các thùng, chai, lọ, hoặc túi với nhiều kích cỡ khác nhau.
- Nhà cung cấp: Có nhiều nhà cung cấp nguyên tố trên thị trường. Lựa chọn nhà cung cấp uy tín và có kinh nghiệm là điều quan trọng để đảm bảo chất lượng của nguyên tố.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Lưu huỳnh mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Lưu huỳnh. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









