Nhôm, với ký hiệu hóa học là Al, là nguyên tố thứ 13 trong bảng tuần hoàn và là một trong những kim loại phổ biến nhất trên trái đất. Được biết đến với đặc tính nhẹ, bền và khả năng chống ăn mòn, nhôm đóng một vai trò quan trọng trong nhiều lĩnh vực của cuộc sống hàng ngày, từ việc sản xuất phương tiện giao thông đến bao bì thực phẩm và nhiều ứng dụng trong ngành công nghiệp. Trong bài viết này các bạn hãy cùng yeuhoahoc.edu.vn khám phá sâu hơn về nguyên tố nhôm, từ tính chất, ứng dụng đến những phát triển mới nhất trong công nghệ liên quan đến nguyên tố này.
Giới thiệu về Nhôm
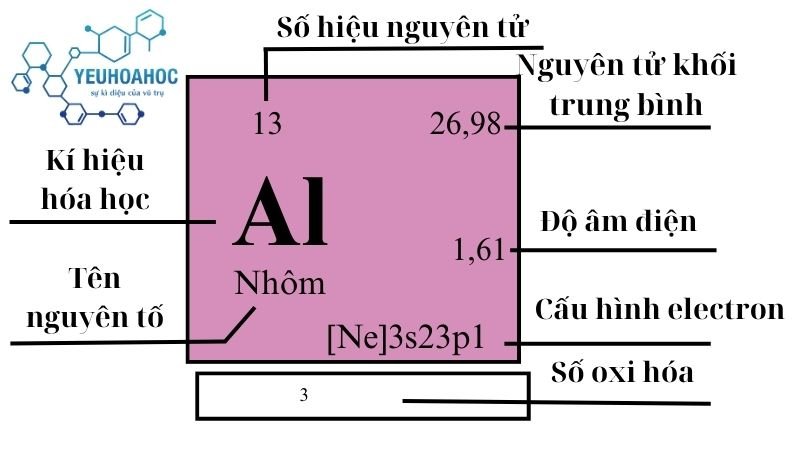
Định nghĩa
- Nhôm là một nguyên tố hóa học có ký hiệu Al (từ tiếng Latinh: Aluminium) và số nguyên tử 13.
- Nhôm là kim loại nhẹ, có màu trắng bạc, mềm dẻo và dễ dát mỏng.
- Nhôm là nguyên tố phổ biến thứ ba trong vỏ Trái Đất (sau oxy và silic) và là kim loại phổ biến nhất.
Lịch sử
- Nhôm được phát hiện vào năm 1825 bởi nhà hóa học người Đan Mạch Hans Christian Ørsted.
- Friedrich Wöhler là người đầu tiên sản xuất được nhôm nguyên chất vào năm 1845.
- Charles Martin Hall và Paul Héroult phát triển phương pháp điện phân để sản xuất nhôm vào năm 1886. Phương pháp này đã giúp giảm giá thành sản xuất nhôm và đưa nhôm vào ứng dụng rộng rãi.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1808: Sir Humphry Davy đề xuất tên gọi “aluminium” cho kim loại này.
- 1825: Hans Christian Ørsted phát hiện ra nhôm.
- 1845: Friedrich Wöhler sản xuất được nhôm nguyên chất.
- 1886: Charles Martin Hall và Paul Héroult phát triển phương pháp điện phân để sản xuất nhôm.
- 1888: Nhôm được sử dụng để sản xuất vỏ lon bia đầu tiên.
- 1903: Anh em nhà Wright sử dụng nhôm để chế tạo máy bay đầu tiên.
- 1952: Nhôm được sử dụng để sản xuất vỏ lon nước ngọt đầu tiên.
Tầm quan trọng của Nhôm trong đời sống con người
Vật liệu xây dựng
- Nhôm là kim loại nhẹ, bền bỉ, dễ gia công, dẫn điện tốt, nên được sử dụng rộng rãi trong xây dựng nhà cửa, công trình, làm khung cửa, mái nhà, vách ngăn, tôn, thép không gỉ,…
Hàng không vũ trụ
- Nhôm là vật liệu quan trọng trong chế tạo máy bay, tàu vũ trụ, do có độ bền cao, trọng lượng nhẹ, giúp tiết kiệm nhiên liệu và tăng hiệu quả bay. Nhôm được sử dụng để sản xuất vỏ máy bay, cánh máy bay, các bộ phận động cơ,…
Đồ gia dụng
- Nhôm được sử dụng để sản xuất nồi, chảo, xoong, các thiết bị điện tử như vỏ điện thoại, laptop, do tính dẫn điện tốt, nhẹ, bền và dễ gia công.
Các lĩnh vực khác
- Nhôm được ứng dụng trong sản xuất ô tô, xe máy, tàu thuyền, dụng cụ thể thao, thiết bị y tế, bao bì thực phẩm,…
Lý do Nhôm được ưa chuộng:
- Nhẹ: Nhôm nhẹ hơn nhiều so với các kim loại khác như thép, đồng, giúp tiết kiệm năng lượng và nguyên vật liệu trong quá trình sản xuất và sử dụng.
- Bền bỉ: Nhôm có khả năng chống ăn mòn tốt, chịu được môi trường khắc nghiệt, tuổi thọ cao.
- Dễ gia công: Nhôm dễ dàng dát mỏng, kéo sợi, đúc, tiện, hàn, giúp tạo ra các sản phẩm với hình dạng và kích thước đa dạng.
- Dẫn điện tốt: Nhôm dẫn điện tốt, được sử dụng rộng rãi trong ngành điện.
- Tái chế: Nhôm có thể tái chế nhiều lần mà không làm giảm chất lượng, giúp bảo vệ môi trường.
Nguyên tố Nhôm trong bảng tuần hoàn hóa học
- Nhôm nằm ở ô số 13 trong bảng tuần hoàn hóa học.
- Nhôm thuộc nhóm 13 (nhóm bo) và chu kỳ 3.
- Nhôm có cấu hình electron hóa trị là 3s²3p¹.
- Nhôm có hóa trị +3.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 13 | 3 | 26,9815386(8) | 2,698 | 933,47 | 2792 | 0,897 | 1,61 | 82300 |
Tính chất của nguyên tố Nhôm
Tính chất vật lý
- Nhôm là kim loại nhẹ, có màu trắng bạc, mềm dẻo và dễ dát mỏng.
- Khối lượng riêng của nhôm là 2,7 g/cm³.
- Nhôm có nhiệt độ nóng chảy là 660°C.
- Nhôm dẫn điện và dẫn nhiệt tốt.
- Nhôm có tính chống ăn mòn cao do có lớp oxit nhôm bảo vệ bề mặt.
Tính chất hóa học
- Nhôm là kim loại có tính khử mạnh.
- Nhôm tác dụng với axit để tạo thành muối và khí hydro.
- Nhôm tác dụng với dung dịch kiềm để tạo thành muối aluminat và khí hydro.
- Nhôm tác dụng với oxi trong không khí để tạo thành lớp oxit nhôm bảo vệ bề mặt.
- Nhôm không tác dụng với nước ở nhiệt độ thường.
Ứng dụng của nguyên tố Nhôm
Tính dẫn điện và dẫn nhiệt tốt:
- Dây dẫn điện: Nhôm được sử dụng để sản xuất dây điện cao thế, dây điện trong nhà, cáp điện thoại,…
- Tản nhiệt: Nhôm được sử dụng làm thanh tản nhiệt cho các thiết bị điện tử như CPU, VGA, LED,…
Nhẹ và bền:
- Ngành hàng không: Nhôm được sử dụng để chế tạo thân máy bay, cánh máy bay,…
- Ngành vận tải: Nhôm được sử dụng để chế tạo khung xe ô tô, xe máy, tàu hỏa,…
- Xây dựng: Nhôm được sử dụng làm cửa sổ, cửa ra vào, mái nhà,…
Dễ gia công và tái chế:
- Đồ dùng gia đình: Nhôm được sử dụng để sản xuất nồi, chảo, bình nước,…
- Bao bì thực phẩm: Nhôm được sử dụng để sản xuất hộp đựng thức ăn, đồ uống,…
- Dụng cụ y tế: Nhôm được sử dụng để sản xuất các dụng cụ y tế như nẹp, kẹp, kim loại,…
Chống ăn mòn tốt:
- Hộp đựng hóa chất: Nhôm được sử dụng để sản xuất thùng chứa hóa chất, axit,…
- Phụ kiện trang sức: Nhôm được sử dụng để sản xuất các loại trang sức như vòng cổ, hoa tai,…
Ngoài ra, nhôm còn được ứng dụng trong nhiều lĩnh vực khác như:
- Sản xuất pin nhiên liệu
- Chế tạo các thiết bị thể thao
- Sản xuất các loại vật liệu composite
Điều chế và sản xuất nguyên tố
Quá trình điều chế và sản xuất nhôm bao gồm hai giai đoạn chính:
Khai thác và xử lý quặng bôxit
Khai thác: Quặng bôxit được khai thác bằng phương pháp lộ thiên hoặc hầm lò.
Xử lý: Quặng bôxit được nghiền mịn và nung nóng với NaOH để tạo thành dung dịch NaAlO2.
Lọc và kết tủa: Dung dịch NaAlO2 được lọc và kết tủa bằng CO2 để tạo thành Al(OH)3.
Nung nóng: Al(OH)3 được nung nóng để tạo thành Al2O3.
Cách tiến hành:
- Nghiền nát quặng bauxite.
- Nung nóng quặng bauxite với NaOH để tạo thành natri aluminat (NaAlO2).
- Hòa tan natri aluminat trong nước.
- Kết tủa Al(OH)3 bằng CO2.
- Lọc rửa và nung calcined Al(OH)3 để thu được Al2O3.
- Điện phân nóng chảy Al2O3 để tạo ra nhôm kim loại.
Điện phân nóng chảy Al2O3

Nguyên liệu: Al2O3 được trộn với criolit (Na3AlF6) để giảm nhiệt độ nóng chảy.
Bình điện phân: Anode được làm bằng than chì, cathode được làm bằng thép.
Quá trình điện phân: Dòng điện được đi qua dung dịch nóng chảy, Al3+ di chuyển về cathode và khử thành Al, O2- di chuyển về anode và oxy hóa thành O2.
Cách tiến hành:
- Chuẩn bị dung dịch muối nhôm nóng chảy.
- Đặt điện cực than vào dung dịch.
- Dòng điện chạy qua dung dịch, tạo ra khí Cl2 tại anot và nhôm kim loại tại catot.
Sản phẩm: Nhôm lỏng được thu ở cathode, khí O2 thoát ra ở anode.
Phương pháp điện phân nóng chảy Al2O3 là phương pháp chính để sản xuất nhôm do có những ưu điểm như:
- Hiệu suất cao
- Năng suất cao
- Chất lượng nhôm tốt
Phương pháp này cũng có một số nhược điểm như:
- Tiêu hao nhiều năng lượng
- Gây ô nhiễm môi trường
Phản ứng hóa học của nguyên tố Nhôm

Nhôm là kim loại có tính khử mạnh, thể hiện qua các phản ứng hóa học sau:
Tác dụng với oxi
- Nhôm tác dụng với oxi trong không khí ở nhiệt độ cao tạo thành oxit nhôm (Al2O3) có màu trắng.
- Phản ứng tỏa nhiệt mạnh, có ngọn lửa sáng chói.
- 4Al + 3O2 -> 2Al2O3
Tác dụng với axit
- Nhôm tác dụng với axit HCl, H2SO4 loãng giải phóng khí hiđro.
- Phản ứng tỏa nhiệt.
- 2Al + 6HCl -> 2AlCl3 + 3H2
- 2Al + 3H2SO4 (loãng) -> Al2(SO4)3 + 3H2
Tác dụng với dung dịch kiềm
- Nhôm tác dụng với dung dịch NaOH, KOH giải phóng khí hiđro và tạo thành muối aluminat.
- Phản ứng tỏa nhiệt.
- 2Al + 2NaOH + 2H2O -> 2NaAlO2 + 3H2
- 2Al + 6KOH + 6H2O -> 2K3AlO3 + 3H2
Tác dụng với dung dịch muối
- Nhôm tác dụng với dung dịch muối của kim loại đứng sau nó trong dãy điện hóa để khử kim loại ra khỏi dung dịch muối.
- 2Al + 3CuSO4 -> Al2(SO4)3 + 3Cu
Ngoài ra, nhôm còn có một số phản ứng hóa học khác như:
- Phản ứng nhiệt nhôm
- Phản ứng khử oxit kim loại
Ứng dụng của các phản ứng hóa học của nhôm:
- Phản ứng của nhôm với oxi được ứng dụng trong hàn nhôm.
- Phản ứng của nhôm với axit được ứng dụng trong sản xuất khí hiđro.
- Phản ứng của nhôm với dung dịch kiềm được ứng dụng trong sản xuất nhôm oxit.
- Phản ứng của nhôm với dung dịch muối được ứng dụng trong mạ nhôm.
Tồn tại và khai thác nguyên tố Nhôm

Tồn tại
- Nhôm là nguyên tố phổ biến thứ ba trong vỏ Trái đất, chiếm khoảng 8,2% khối lượng.
- Nó không tồn tại ở dạng tự do mà chủ yếu dưới dạng hợp chất, phổ biến nhất là quặng bôxit (Al2O3.nH2O).
- Bôxit được tìm thấy ở nhiều nơi trên thế giới, với trữ lượng lớn nhất ở Úc, Guinea, Việt Nam, Brazil và Jamaica.
Khai thác
- Quặng bôxit được khai thác bằng phương pháp lộ thiên hoặc hầm lò.
- Sau khi khai thác, quặng được nghiền mịn và nung nóng với NaOH để tạo thành dung dịch NaAlO2.
- Dung dịch NaAlO2 được lọc và kết tủa bằng CO2 để tạo thành Al(OH)3.
- Al(OH)3 được nung nóng để tạo thành Al2O3.
Tác động môi trường
- Khai thác và chế biến quặng bôxit có thể gây ra một số tác động môi trường như:
- Phá hủy môi trường sống
- Ô nhiễm nguồn nước
- Gây ô nhiễm không khí
Giải pháp
- Cần áp dụng các biện pháp khai thác và chế biến quặng bôxit bền vững để giảm thiểu tác động môi trường.
- Tái chế nhôm là một giải pháp hiệu quả để bảo vệ môi trường và tài nguyên thiên nhiên.
Vấn đề an toàn khi sử dụng nguyên tố Nhôm
Bụi nhôm
- Bụi nhôm có thể gây kích ứng da, mắt và hệ hô hấp.
- Hít phải bụi nhôm trong thời gian dài có thể dẫn đến bệnh phổi.
- Cần sử dụng các biện pháp bảo hộ như khẩu trang, kính bảo hộ khi làm việc với bụi nhôm.
Hợp chất nhôm
- Một số hợp chất nhôm như nhôm sunfat có thể gây kích ứng da và mắt.
- Nuốt phải hợp chất nhôm có thể gây ngộ độc.
- Cần cẩn thận khi sử dụng các hợp chất nhôm và tránh để trẻ em tiếp xúc.
Cháy nổ
- Nhôm dạng bột mịn có thể cháy nổ trong điều kiện thích hợp.
- Cần cẩn thận khi sử dụng nhôm dạng bột mịn và tránh để tiếp xúc với lửa.
Tái chế nhôm
- Quá trình tái chế nhôm có thể thải ra khí độc hại.
- Cần thực hiện tái chế nhôm theo quy trình an toàn để bảo vệ môi trường và sức khỏe con người.
Để đảm bảo an toàn khi sử dụng nhôm, cần lưu ý:
- Sử dụng các biện pháp bảo hộ khi làm việc với bụi nhôm hoặc hợp chất nhôm.
- Tránh để trẻ em tiếp xúc với nhôm và các hợp chất của nhôm.
- Cẩn thận khi sử dụng nhôm dạng bột mịn.
- Thực hiện tái chế nhôm theo quy trình an toàn.
Chất lượng và phương thức cung cấp nguyên tố Nhôm
Chất lượng Nhôm
- Nhôm được phân loại theo độ tinh khiết, từ 99,0% đến 99,99%.
- Nhôm có độ tinh khiết cao được sử dụng trong các ứng dụng đòi hỏi độ dẫn điện và dẫn nhiệt tốt, như dây điện và thanh tản nhiệt.
- Nhôm có độ tinh khiết thấp được sử dụng trong các ứng dụng không đòi hỏi độ tinh khiết cao, như vật liệu xây dựng và đồ gia dụng.
Phương thức cung cấp Nhôm
Nhôm được cung cấp dưới dạng:
-
- Thỏi
- Tấm
- Dây
- Ống
- Bột
Trên đây là tất cả những kiến thức cơ bản về nguyên tố Nhôm mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Nhôm. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









