Nguyên tố Neon, với sự tinh khiết và độ ổn định đặc biệt, là một trong những thành viên nổi bật của nhóm các khí hiếm trên bảng tuần hoàn hóa học. Bài viết này yeuhohoc.edu.vn sẽ cung cấp cái nhìn tổng quan về Neon, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về Neon
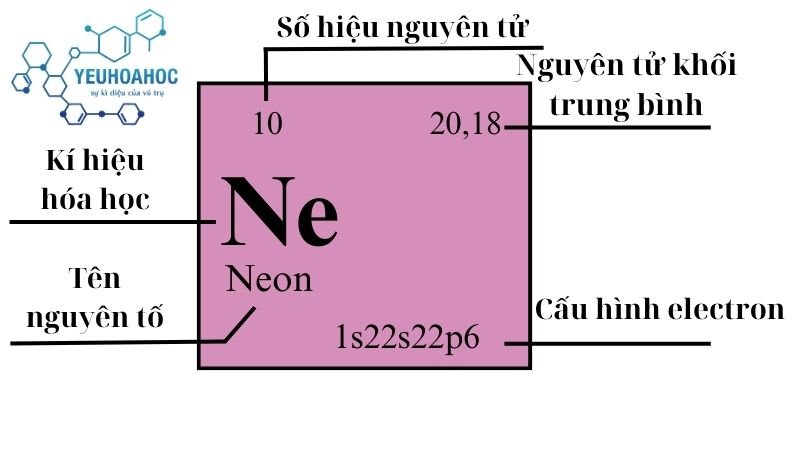
Định nghĩa
- Neon là nguyên tố hóa học thứ 10 trong bảng tuần hoàn, ký hiệu Ne và có số hiệu nguyên tử 10.
- Nó là một khí hiếm, không màu, mùi,vị
- Neon có khối lượng nguyên tử là 20,1797 u.
Lịch sử
- Neon được phát hiện vào năm 1898 do hai nhà hóa học người Anh là William Ramsay và Morris Travers.
- Họ đã phát hiện ra Neon bằng cách hóa lỏng không khí và phân tích các thành phần của nó.
- Dưới đây là một số mốc thời gian quan trọng trong lịch sử phát hiện Neon:
- 1898: Nhà hóa học William Ramsay và Morris Travers phát hiện ra Neon.
- 1902: Georges Claude phát minh ra đèn neon đầu tiên.
- 1910: Claude bắt đầu sản xuất đèn neon thương mại.
- 1923: Đèn neon được sử dụng lần đầu tiên cho biển quảng cáo.
- 1930: Đèn neon trở nên phổ biến trên toàn thế giới.
Tầm quan trọng
- Neon có vai trò quan trọng trong vũ trụ.
- Neon được tìm thấy trong các ngôi sao, tinh vân và khí quyển của các hành tinh.
- Neon cũng có vai trò quan trọng trong đời sống con người.
- Nó đã được áp dụng trong đa dạng các lĩnh vực, bao gồm:
- Đèn neon: Neon được sử dụng để tạo ra ánh sáng màu đỏ đặc trưng cho đèn neon.
- Laser: Neon được sử dụng trong một số loại laser.
- Công nghiệp điện tử: Neon được sử dụng trong một số loại bóng đèn và ống dẫn điện.
- Y học: Neon được sử dụng trong một số loại thuốc và phương pháp điều trị.
Nguyên tố Neon trong bảng tuần hoàn hóa học
Neon nằm trong nhóm các khí hiếm trên bảng tuần hoàn hóa học, cùng với các nguyên tố khí khác như argon, krypton và xenon. Nó có cấu trúc electron đầy đủ với tám electron ở lớp ngoài cùng, làm cho nó trở thành một trong những nguyên tố ổn định nhất trong tự nhiên.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 18 | 2 | 20,1797(6)2 3 | 0,0008999 | 24,56 | 27,07 | 1,03 | – | 0,005 |
Tính chất của Neon
Tính chất vật lý
- Neon là khí không màu, không mùi, không vị.
- Nó ít tan trong nước.
- Neon là khí nặng hơn heli nhưng nhẹ hơn hầu hết các khí khác.
- Một số tính chất vật lý cụ thể của Neon:
- Nhiệt độ nóng chảy: -248,59 °C
- Nhiệt độ sôi: -246,08 °C
- Mật độ: 0,900 g/L
- Khối lượng nguyên tử: 20,1797 u
Tính chất hóa học
- Neon là khí hiếm, ít phản ứng hóa học.
- Nó có cấu hình electron bền với 8 electron hóa trị.
- Do đó, Neon ít khi tham gia vào các phản ứng hóa học.
- Tuy nhiên, Neon có thể tạo thành hợp chất với một số nguyên tố khác trong điều kiện đặc biệt.
- Ví dụ, Neon có thể tạo thành hợp chất với florua để tạo ra tetrafluoroneon (NeF4).
Ngoài ra, Neon còn có một số tính chất khác như:
- Neon là khí trơ, không dẫn điện.
- Neon có thể phát ra ánh sáng màu đỏ cam khi bị kích thích bởi điện.
Ứng dụng của Neon
Bảng hiệu quảng cáo
- Neon được sử dụng phổ biến để tạo ra các bảng hiệu quảng cáo rực rỡ.
- Ánh sáng màu đỏ đặc trưng của Neon rất thu hút sự chú ý và có thể nhìn thấy từ xa.
Đèn huỳnh quang:

- Neon được sử dụng trong các đèn huỳnh quang để tạo ra ánh sáng màu đỏ.
- Khi điện đi qua khí Neon, nó sẽ phát ra ánh sáng màu đỏ.
Khoa học và kỹ thuật:
- Neon được sử dụng trong một số ứng dụng khoa học và kỹ thuật, bao gồm:
- Khí trơ trong các thiết bị điện tử: Neon được sử dụng trong các thiết bị điện tử để ngăn ngừa hồ quang và sự ăn mòn.
- Chất làm lạnh trong các hệ thống cryogenic: Neon được sử dụng để làm lạnh các thiết bị và vật liệu đến nhiệt độ rất thấp.
- Theo dõi rò rỉ khí: Neon được sử dụng để theo dõi rò rỉ khí trong các hệ thống kín.
Điều chế và sản xuất nguyên tố Neon
Neon là nguyên tố phổ biến thứ 10 trong vũ trụ, nhưng nó chỉ chiếm 0,0018% bầu khí quyển Trái đất. Do đó, việc điều chế và sản xuất Neon khá phức tạp và tốn kém.
Có hai phương pháp chính để điều chế Neon:
Phương pháp hóa lỏng không khí
- Đây là phương pháp phổ biến nhất để sản xuất Neon.
- Không khí được hóa lỏng ở nhiệt độ rất thấp (-194 °C).
- Sau đó, các thành phần khác nhau của không khí được tách ra bằng phương pháp chưng cất phân đoạn.
- Neon có nhiệt độ sôi thấp hơn hầu hết các khí khác trong không khí, do đó nó có thể được thu thập dễ dàng.
Phương pháp phân rã phóng xạ
- Phương pháp này sử dụng nguyên tố phóng xạ để tạo ra Neon.
- Ví dụ, khi đồng vị phóng xạ 22Na phân rã, nó sẽ tạo ra neon-22.
- Phương pháp này chỉ được sử dụng để sản xuất một lượng nhỏ Neon.
Quá trình sản xuất Neon bao gồm các bước sau
- Thu thập nguyên liệu: Không khí là nguyên liệu chính để sản xuất Neon.
- Hóa lỏng không khí: Không khí được hóa lỏng ở nhiệt độ rất thấp (-194 °C).
- Chưng cất phân đoạn: Các thành phần khác nhau của không khí được tách ra bằng phương pháp chưng cất phân đoạn.
- Thu thập Neon: Neon có nhiệt độ sôi thấp hơn hầu hết các khí khác trong không khí, do đó nó có thể được thu thập dễ dàng.
- Lọc và tinh chế: Neon được lọc và tinh chế để loại bỏ các tạp chất.
- Đóng chai và vận chuyển: Neon được đóng chai và vận chuyển đến nơi sử dụng.
Phản ứng hóa học của Neon

Neon là một khí hiếm, có cấu hình electron bền với 8 electron hóa trị. Do đó, Neon ít khi tham gia vào các phản ứng hóa học. Tuy nhiên, Neon có thể tạo thành một số hợp chất trong điều kiện đặc biệt.
Dưới đây là một số ví dụ về phản ứng hóa học của Neon:
Phản ứng với florua
- Neon có thể phản ứng với florua để tạo thành tetrafluoroneon (NeF4).
- Đây là hợp chất bền nhất của Neon.
- Phản ứng này cần được thực hiện ở nhiệt độ cao và có sự hiện diện của chất xúc tác.
Phản ứng với hydro
- Neon có thể phản ứng với hydro để tạo thành neon hydride (NeH+).
- Tuy nhiên, hợp chất này rất không bền và chỉ tồn tại ở dạng ion.
Phản ứng với các nguyên tố khác
- Neon có thể phản ứng với một số nguyên tố khác như oxy, nitơ và carbon trong điều kiện đặc biệt.
- Tuy nhiên, các phản ứng này thường xảy ra rất chậm và tạo ra các hợp chất không bền.
Ngoài ra, Neon còn có thể tham gia vào một số phản ứng vật lý như:
- Phản ứng quang hóa: Neon có thể phát ra ánh sáng màu đỏ cam khi bị kích thích bởi điện.
- Phản ứng phân rã: Neon có thể phân rã thành các đồng vị khác nhau.
Tồn tại và khai thác nguyên tố Neon
Neon tồn tại trong tự nhiên dưới dạng khí tự do trong bầu khí quyển Trái đất. Nó cũng được tìm thấy trong một số khoáng chất như cryolite và fluorite.
Có hai phương pháp chính để khai thác Neon:
Khai thác từ bầu khí quyển
- Đây là phương pháp phổ biến nhất để khai thác Neon.
- Không khí được hóa lỏng ở nhiệt độ rất thấp (-194 °C).
- Sau đó, các thành phần khác nhau của không khí được tách ra bằng phương pháp chưng cất phân đoạn.
- Neon có nhiệt độ sôi thấp hơn hầu hết các khí khác trong không khí, do đó nó có thể được thu thập dễ dàng.
Khai thác từ khoáng chất
- Neon có thể được khai thác từ một số khoáng chất như cryolite và fluorite.
- Tuy nhiên, phương pháp này ít phổ biến hơn phương pháp khai thác từ bầu khí quyển vì nó tốn kém và gây ô nhiễm môi trường.
Quá trình khai thác Neon bao gồm các bước sau
- Thu thập nguyên liệu: Không khí hoặc khoáng chất là nguyên liệu chính để khai thác Neon.
- Hóa lỏng không khí: Không khí được hóa lỏng ở nhiệt độ rất thấp (-194 °C).
- Chưng cất phân đoạn: Các thành phần khác nhau của không khí được tách ra bằng phương pháp chưng cất phân đoạn.
- Thu thập Neon: Neon có nhiệt độ sôi thấp hơn hầu hết các khí khác trong không khí, do đó nó có thể được thu thập dễ dàng.
- Lọc và tinh chế: Neon được lọc và tinh chế để loại bỏ các tạp chất.
- Đóng chai và vận chuyển: Neon được đóng chai và vận chuyển đến nơi sử dụng.
Vấn đề an toàn khi sử dụng nguyên tố Neon
Neon thường được coi là một nguyên tố an toàn. Tuy nhiên, Neon có thể gây ra một số nguy cơ an toàn tiềm ẩn, bao gồm:
Ngạt thở:
- Neon là một khí nặng hơn không khí.
- Do đó, nó có thể thay thế oxy trong không khí và gây ra ngạt thở nếu hít phải một lượng lớn.
- Cần đảm bảo thông gió đầy đủ khi sử dụng Neon trong không gian kín.
Nguy cơ nổ:
- Neon có thể tạo thành hỗn hợp dễ nổ với một số chất khác như oxy và hydro.
- Cần cẩn thận khi sử dụng Neon gần các chất dễ cháy hoặc dễ nổ.
Nguy cơ rò rỉ:
- Neon được lưu trữ dưới áp suất cao.
- Rò rỉ Neon có thể gây ra nguy cơ ngạt thở và nguy cơ nổ.
- Cần kiểm tra rò rỉ thường xuyên và sử dụng các biện pháp an toàn thích hợp khi sử dụng Neon.
Chất lượng và phương thức cung cấp nguyên tố Neon
Chất lượng Neon
- Neon có thể được cung cấp ở nhiều cấp độ chất lượng khác nhau, tùy thuộc vào mục đích sử dụng.
- Neon có độ tinh khiết cao (99,999%) được sử dụng trong các ứng dụng khoa học và công nghiệp.
- Neon có độ tinh khiết thấp hơn (99,5%) được sử dụng trong các ứng dụng thương mại như biển quảng cáo.
Phương thức cung cấp Neon
- Neon được cung cấp bởi các nhà sản xuất khí công nghiệp.
- Nó có thể được mua dưới dạng khí nén trong các bình thép hoặc trong các ống nghiệm.
- Neon cũng có thể được mua dưới dạng hỗn hợp khí với các khí khác như argon hoặc helium.
Giá cả Neon
- Giá Neon phụ thuộc vào độ tinh khiết, số lượng và phương thức cung cấp.
- Neon có độ tinh khiết cao thường đắt hơn Neon có độ tinh khiết thấp.
- Neon mua dưới dạng khí nén thường đắt hơn Neon mua dưới dạng hỗn hợp khí.
Dưới đây là tất cả những kiến thức cơ bản về nguyên tố Neon mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Neon. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









