Nguyên tố Oxy (O) là một trong những nguyên tố quan trọng và phổ biến nhất trên Trái Đất. Với tính chất đặc biệt và ứng dụng đa dạng, oxy đóng vai trò không thể phủ nhận trong nhiều lĩnh vực khác nhau. Bài viết này yeuhohoc.edu.vn sẽ giới thiệu về nguyên tố Oxy, bao gồm lịch sử, tính chất, ứng dụng, và các vấn đề an toàn liên quan.
Giới Thiệu về Nguyên Tố Oxy
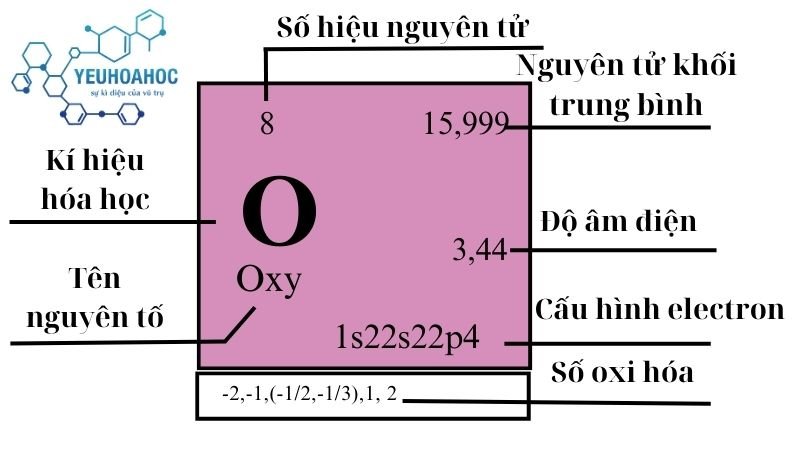
Định nghĩa
Oxy là nguyên tố hóa học có ký hiệu O, tên tiếng Anh là Oxygen, số nguyên tử là 8.
Oxy là nguyên tố phổ biến thứ ba trong vũ trụ theo khối lượng, sau hydro và heli.
Oxy là nguyên tố phổ biến nhất trong vỏ Trái Đất, chiếm gần 50% khối lượng vỏ Trái Đất.
Oxy tồn tại ở dạng khí (O2) trong điều kiện bình thường.
Lịch sử
Oxy được phát hiện vào năm 1774 bởi Joseph Priestley, một nhà khoa học người Anh.
Carl Wilhelm Scheele, một nhà hóa học người Thụy Điển, cũng phát hiện ra oxy vào năm 1772, nhưng công trình của ông được công bố sau Priestley.
Antoine Lavoisier, một nhà hóa học người Pháp, là người đầu tiên đặt tên cho oxy là “oxygène” vào năm 1777.
Các mốc quan trọng trong việc hình thành nguyên tố Oxy:
- Oxy được hình thành trong Vụ Nổ Lớn (Big Bang) khoảng 13,8 tỷ năm trước.
- Oxy được tạo ra bởi sự quang hợp của các sinh vật quang hợp như thực vật và vi tảo.
- Oxy được giải phóng vào bầu khí quyển thông qua quá trình hô hấp của các sinh vật hiếu khí.
Tầm quan trọng
Oxy đóng vai trò thiết yếu trong sự sống.
Oxy được sử dụng bởi tất cả các sinh vật hiếu khí để hô hấp.
Oxy cũng tham gia vào nhiều phản ứng hóa học khác nhau, bao gồm cả quá trình cháy.
Oxy là nguyên liệu quan trọng trong công nghiệp hóa chất.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 16 | 2 | 15,9992 4 9 | 0,001429 | 54,36 | 90,20 | 0,918 | 3,44 | 461000 |
Tính chất của oxy

Tính chất vật lý
- Oxy là một loại khí không màu, không có mùi và không có vị.
- Oxy ít tan trong nước.
- Oxy nặng hơn không khí.
- Oxy hóa lỏng ở nhiệt độ -183°C.
- Oxy hóa rắn ở nhiệt độ -218°C.
Tính chất hóa học
- Oxy là chất oxi hóa mạnh.
- Oxy hỗ trợ sự hô hấp của hầu hết các sinh vật.
- Oxy tham gia vào sự cháy của nhiều chất.
- Oxy có thể tạo hợp chất với hầu hết các nguyên tố khác.
Dưới đây là một số ví dụ cụ thể về tính chất hóa học của oxy:
- Hỗ trợ sự hô hấp: Oxy hòa tan vào hemoglobin trong máu để mang oxy đến các tế bào trong cơ thể.
- Hỗ trợ sự cháy: Oxy là chất oxi hóa trong nhiều phản ứng cháy, ví dụ như:
C + O2 -> CO2
- Tạo hợp chất với nhiều nguyên tố khác: Oxy có thể tạo hợp chất với hầu hết các nguyên tố khác, ví dụ như:
– Nước (H2O): Oxy kết hợp với hydro để tạo thành nước.
– Carbon dioxide (CO2): Oxy kết hợp với carbon để tạo thành carbon dioxide.
– Sắt(III) oxit (Fe2O3): Oxy kết hợp với sắt để tạo thành sắt(III) oxit.
Lưu ý:
- Oxy có thể phản ứng với nhiều nguyên tố khác nhau, do đó cần lưu ý khi sử dụng oxy để tránh các phản ứng nguy hiểm.
- Oxy là chất oxi hóa mạnh, do đó cần cẩn thận khi sử dụng oxy để tránh các vụ cháy nổ.
Ứng dụng của oxy
Y tế
Oxy được sử dụng để điều trị các bệnh về hô hấp như hen suyễn, viêm phổi, và bệnh phổi tắc nghẽn mãn tính (COPD).
Oxy được sử dụng trong các ca phẫu thuật để giúp bệnh nhân thở dễ dàng hơn và giảm nguy cơ biến chứng.
Oxy cũng được sử dụng để giảm đau và tăng cường hệ miễn dịch.
Công nghiệp
- Oxy được sử dụng để sản xuất thép, axit nitric, thủy tinh, và nhiều sản phẩm công nghiệp khác.
- Oxy được sử dụng trong hàn cắt kim loại để tạo ra nhiệt độ cao cần thiết để nung chảy kim loại.
Nông nghiệp
- Oxy được sử dụng để nuôi trồng thủy sản để tăng lượng oxy trong nước và giúp cá phát triển tốt hơn.
- Oxy được sử dụng để tăng cường sự phát triển của cây trồng bằng cách thúc đẩy quá trình quang hợp.
Ngoài ra, oxy còn có một số ứng dụng khác như:
- Lặn biển: Oxy được sử dụng để giúp thợ lặn thở dưới nước.
- Hàng không: Oxy được sử dụng để cung cấp cho phi công và hành khách trên máy bay.
- Thể thao: Oxy được sử dụng để giúp các vận động viên tăng cường sức bền và thành tích thi đấu.
Điều chế và sản xuất nguyên tố Oxy
Điều chế Oxy
Phương pháp điều chế
Có nhiều phương pháp để điều chế oxy, bao gồm:
- Phân hủy các hợp chất chứa oxy:
- Phân hủy bằng nhiệt:
Nung nóng kali permanganat (KMnO4) hoặc kali chlorat (KClO3)
2KMnO4 -> K2MnO4 + MnO2 + O2
2KClO3 -> 2KCl + 3O2
Nung nóng canxi cacbonat (CaCO3)
CaCO3 -> CaO + CO2
- Phân hủy bằng điện phân:
Điện phân nước
2H2O -> 2H2 + O2
- Lọc không khí:
Phương pháp này sử dụng zeolit để hấp thụ nitơ, thu được oxy tinh khiết.
Sản xuất oxy

- Sản xuất oxy từ không khí:
- Đây là phương pháp phổ biến nhất để sản xuất oxy.
- Quá trình sản xuất bao gồm:
- Nén không khí
- Làm lạnh không khí
- Ngưng tụ và hóa lỏng không khí
- Phân tách oxy lỏng khỏi các khí khác (nitơ, argon, carbon dioxide)
- Sản xuất oxy từ các hợp chất chứa oxy:
- Phương pháp này được sử dụng khi cần oxy có độ tinh khiết cao.
- Các hợp chất thường được sử dụng là kali permanganat (KMnO4) và kali chlorat (KClO3).
Phản ứng của nguyên tố Oxy
Phản ứng cháy: Oxy là chất oxi hóa trong nhiều phản ứng cháy. Ví dụ:
- Sắt cháy trong oxy:
3Fe + 2O2 -> Fe3O4
- Cacbon cháy trong oxy:
C + O2 -> CO2
- Magiê cháy trong oxy:
2Mg + O2 -> 2MgO
Phản ứng hô hấp: Oxy là nguyên tố thiết yếu cho sự hô hấp của hầu hết các sinh vật. Ví dụ:
C6H12O6 + 6O2 -> 6CO2 + 6H2O
Phản ứng hóa hợp: Oxy có thể tạo hợp chất với hầu hết các nguyên tố khác. Ví dụ:
- Oxy và hydro tạo thành nước:
2H2 + O2 -> 2H2O
- Oxy và carbon tạo thành carbon dioxide:
C + O2 -> CO2
- Oxy và nitơ tạo thành nitơ oxit:
N2 + O2 -> 2NO
Phản ứng phân hủy: Một số hợp chất có thể phân hủy thành oxy và các nguyên tố khác. Ví dụ:
2KClO3 -> 2KCl + 3O2
Tồn tại và khai thác oxy
Tồn tại

Khí oxy: Đây là dạng phổ biến nhất của oxy, chiếm khoảng 21% bầu khí quyển Trái đất.
Nước: Oxy là một thành phần của nước, chiếm khoảng 89% khối lượng nước.
Hợp chất: Oxy có thể kết hợp với các nguyên tố khác để tạo thành các hợp chất như oxit, cacbonat, silicat, v.v.
Khai thác
Không khí: Đây là nguồn khai thác oxy phổ biến nhất. Quá trình khai thác oxy từ không khí bao gồm:
- Nén không khí
- Làm lạnh không khí
- Ngưng tụ và hóa lỏng không khí
- Phân tách oxy lỏng khỏi các khí khác (nitơ, argon, carbon dioxide)
Nước: Oxy có thể được tách ra khỏi nước bằng phương pháp điện phân.
Hợp chất: Oxy có thể được tách ra khỏi một số hợp chất như kali permanganat (KMnO4) và kali chlorat (KClO3) bằng phương pháp nung nóng.
Vấn đề an toàn khi sử dụng oxy
Nguy cơ cháy nổ
- Oxy là chất oxi hóa mạnh, do đó nó có thể làm tăng nguy cơ cháy nổ.
- Cần cẩn thận khi sử dụng oxy gần các nguồn nhiệt, tia lửa điện hoặc các vật liệu dễ cháy.
- Cần trang bị đầy đủ các thiết bị phòng cháy chữa cháy khi sử dụng oxy.
Nguy cơ ngộ độc oxy
- Hít thở oxy tinh khiết trong thời gian dài có thể dẫn đến ngộ độc oxy.
- Các triệu chứng của ngộ độc oxy bao gồm: ho, khó thở, đau ngực, co giật, và thậm chí tử vong.
- Cần sử dụng oxy theo hướng dẫn của bác sĩ hoặc chuyên gia y tế.
Nguy cơ tổn thương mắt
- Áp suất oxy cao có thể gây tổn thương mắt.
- Cần đeo kính bảo hộ khi sử dụng oxy dưới áp suất cao.
Nguy cơ bỏng lạnh
- Tiếp xúc với oxy lỏng có thể gây ra những vết bỏng lạnh nghiêm trọng.
- Cần cẩn thận khi tiếp xúc với oxy lỏng.
- Cần sử dụng các thiết bị bảo hộ khi tiếp xúc với oxy lỏng.
Chất lượng và phương thức cung cấp oxy
Chất lượng oxy
Chất lượng oxy được xác định bởi độ tinh khiết của nó. Oxy có cấp y tế là loại tinh khiết nhất và được sử dụng trong các bệnh viện và các cơ sở chăm sóc sức khỏe khác. Oxy công nghiệp ít tinh khiết hơn và được sử dụng cho các mục đích như hàn cắt kim loại và sản xuất thép.
Phương thức cung cấp oxy
Oxy có thể được cung cấp theo một số cách khác nhau, bao gồm:
- Bình oxy: Đây là cách phổ biến nhất để cung cấp oxy. Bình oxy chứa oxy nén dưới áp suất cao.

Máy tạo oxy: Máy tạo oxy là các thiết bị lấy oxy từ không khí và cô đặc nó. Máy tạo oxy thường được sử dụng trong nhà bởi những người cần oxy bổ sung.
Oxy lỏng: Oxy lỏng là oxy đã được hóa lỏng. Nó được vận chuyển trong các thùng chứa đặc biệt và được sử dụng cho các ứng dụng cần lượng oxy lớn.
Lựa chọn phương thức cung cấp oxy
Phương thức cung cấp oxy tốt nhất cho bạn sẽ phụ thuộc vào nhu cầu cụ thể của bạn. Nếu bạn cần oxy bổ sung để sử dụng tại nhà, thì bình oxy hoặc máy tạo oxy có thể là lựa chọn tốt nhất cho bạn. Nếu bạn cần oxy cho một ứng dụng công nghiệp, thì oxy lỏng có thể là lựa chọn tốt nhất cho bạn
Dưới đây là tất cả những kiến thức cơ bản về nguyên tố Oxy mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Oxy. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









