Nguyên tố Lithi, với ký hiệu hóa học Li và số nguyên tử 3, là một trong những nguyên tố có sự hiện diện ít nhiều nhất trong tự nhiên. Dù vậy, tầm quan trọng của nó trong nhiều lĩnh vực đã được khám phá và phát triển qua các thế kỷ. Trong nội dung bài viết dưới đây yeuhoahoc.edu.vn sẽ làm rõ và chi nhất về nguyên tố Lithi từ khái niệm, tính chất, ứng dụng cho đến chất lượng của nó
Giới thiệu về Lithi
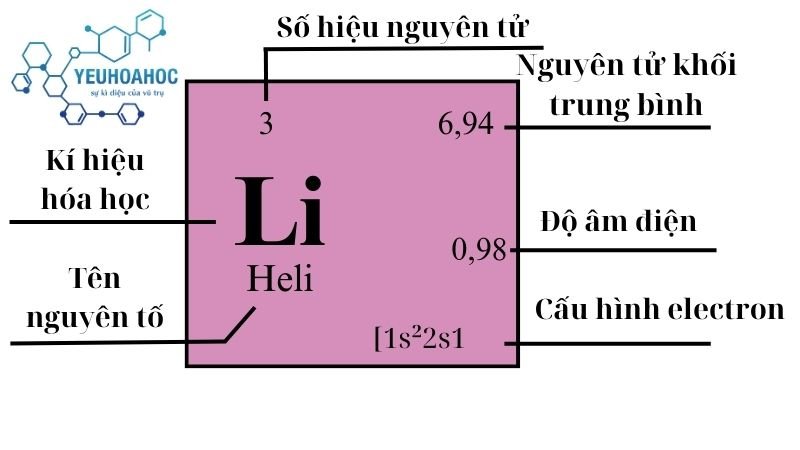
Định nghĩa
- Lithi (còn gọi là liti) có tên tiếng anh là LIthium là một nguyên tố hóa học có ký hiệu Li và số hiệu nguyên tử 3 và thuộc nhóm I trong bảng tuần hoàn hóa học.
- Nó là kim loại kiềm mềm, màu trắng bạc, là nguyên tố rắn nhẹ nhất và có mật độ thấp nhất trong bảng tuần hoàn.
- Lithi có tính phản ứng cao và dễ cháy trong nước.
Lịch sử
- Lithi được phát hiện vào năm 1817 bởi nhà hóa học người Thụy Điển Johan August Arfwedson.
- Ông đã phân tích khoáng chất petalit và tìm thấy một nguyên tố mới, mà ông đặt tên là “lithion”, từ tiếng Hy Lạp “lithos” có nghĩa là “đá”.
Tầm quan trọng
Trong vũ trụ: Lithi là nguyên tố nhẹ thứ ba sau hydro và heli, được hình thành trong quá trình Nổ Lớn.
Trong đời sống con người:
- Lithi được sử dụng trong pin lithium-ion, là nguồn năng lượng cho nhiều thiết bị điện tử như điện thoại di động, máy tính xách tay và xe điện.
- Lithi cũng được sử dụng trong một số loại thuốc điều trị rối loạn tâm trạng, chẳng hạn như rối loạn lưỡng cực.
- Lithi có tiềm năng ứng dụng trong y học hạt nhân để điều trị ung thư.
Nguyên tố Lithi trong bảng tuần hoàn hóa học
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/gK |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 1 | 2 | 6,942 3 4 5 9 | 0,534 | 453,69 | 1560 | 3,582 | 0,98 | 20 |
Tính chất vật lý và hóa học của Lithi
Tính chất vật lý
- Lithi là kim loại mềm, nhẹ và có màu trắng bạc.
- Nó là nguyên tố rắn nhẹ nhất và có mật độ thấp nhất trong bảng tuần hoàn.
- Lithi có điểm nóng chảy thấp (180,5 °C) và điểm sôi cao (1317 °C).
- Có khả năng dẫn điện, dẫn nhiệt rất tốt.
Tính chất hóa học
- Lithi có hoạt động hóa học cao.
- Nó dễ khử ion Li+.
- Lithi tạo hợp chất với nhiều nguyên tố khác, chẳng hạn như oxy, hydro, nitơ và halogen.
Dưới đây là một số ví dụ về tính chất hóa học của Lithi:
- Phản ứng với nước: Lithi phản ứng với nước tạo thành lithi hydroxit (LiOH) và khí hydro (H2).
- Phản ứng với axit: Lithi phản ứng với axit tạo thành muối lithi.
- Phản ứng với oxy: Lithi phản ứng với oxy tạo thành lithi oxit (Li2O).
- Phản ứng với halogen: Lithi phản ứng với halogen tạo thành muối lithi halogenua.
Ứng dụng của Nguyên tố Lithi
Lithi có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau:
Pin lithium-ion: Đây là ứng dụng quan trọng nhất của lithi. Pin lithium-ion được sử dụng trong nhiều thiết bị điện tử như điện thoại di động, máy tính xách tay và xe điện.

Y học: Lithi được sử dụng để điều trị rối loạn lưỡng cực. Nó cũng có tiềm năng ứng dụng trong điều trị ung thư và các bệnh neurodegenerative.
Hợp kim: Lithi được sử dụng để làm hợp kim nhẹ và có độ bền cao, được sử dụng trong ngành hàng không vũ trụ và ô tô.
Kính: Lithi được sử dụng để sản xuất kính quang học và kính chịu nhiệt.
Dầu bôi trơn: Lithi được sử dụng để sản xuất dầu bôi trơn có khả năng chịu nhiệt độ cao.
Nhiên liệu hạt nhân: Lithi-6 được sử dụng trong sản xuất tritium, một loại nhiên liệu hạt nhân.
Hóa chất: Lithi được sử dụng để sản xuất một số loại hóa chất, chẳng hạn như lithi hydroxit và lithi carbonate.
Điều chế và Sản xuất Lithi
Đúng vậy, Lithi có thể được điều chế bằng hai phương pháp chính:
Điện phân
- Phương pháp này sử dụng hỗn hợp nóng chảy của muối Lithi, thường là Lithium chloride (LiCl) hoặc Lithium carbonate (Li2CO3).
- Dòng điện được truyền qua hỗn hợp, tạo ra khí Lithi ở catôt.
- Khí Lithi được thu gom và hóa lỏng.
Phương pháp điện phân có ưu điểm:
- Hiệu quả cao
- Sản phẩm có độ tinh khiết cao
Nhưng nhược điểm:
- Tốn năng lượng
- Chi phí cao
Trích ly từ khoáng vật
- Phương pháp này sử dụng các khoáng vật giàu Lithi như Spodumene, Lepidolite và Amblygonite.
- Quá trình trích ly bao gồm nghiền mịn khoáng vật, hòa tan trong axit và sau đó sử dụng các phương pháp hóa học để thu hồi Lithi.
Phương pháp trích ly từ khoáng vật có ưu điểm:
- Ít tốn năng lượng hơn so với điện phân
- Chi phí thấp hơn
Nhưng nhược điểm:
- Hiệu quả thấp hơn
- Sản phẩm có độ tinh khiết thấp hơn
Phản ứng của nguyên tố Lithi
Lithi là một kim loại kiềm có tính hoạt động hóa học cao. Nó phản ứng với nhiều nguyên tố và hợp chất khác nhau.
Phản ứng với nước
- Lithi phản ứng với nước tạo thành Lithium hydroxit (LiOH) và khí Hydro (H2).
- Phản ứng này tỏa nhiệt mạnh và có thể gây bỏng da.
- 2Li + 2H2O → 2LiOH + H2
Phản ứng với axit
- Lithi phản ứng với axit tạo thành muối Lithi.
- Ví dụ:
- Li + HCl → LiCl + H2
- 2Li + H2SO4 → Li2SO4 + H2
Phản ứng với oxy
- Lithi phản ứng với oxy tạo thành Lithium oxit (Li2O).
- Phản ứng này tỏa nhiệt và xảy ra nhanh chóng.
- 4Li + O2 → 2Li2O
Phản ứng với halogen
- Lithi phản ứng với halogen tạo thành muối Lithium halogenua.
- Ví dụ:
- 2Li + F2 → 2LiF
- 2Li + Cl2 → 2LiCl
Phản ứng với kim loại khác
Lithi phản ứng với một số kim loại khác tạo thành hợp kim.
Ví dụ:
- Li + Na → LiNa
- 2Li + Mg → Li2Mgt.
Tồn tại và khai thác Lithi
Tồn tại
- Lithi là nguyên tố phổ biến thứ 25 trong vỏ Trái Đất, với hàm lượng khoảng 20 ppm.
- Nó tồn tại dưới dạng khoáng sản như petalit, spodumene, amblygonite và lepidolite.
- Lithi cũng tồn tại trong nước biển, với hàm lượng khoảng 0,17 mg/L.
Khai thác

- Lithi được khai thác từ quặng.
- Hai phương pháp khai thác chính là khai thác mỏ lộ thiên và khai thác ngầm.
- Quá trình khai thác và tinh chế Lithi khá phức tạp và bao gồm các bước sau:
- Khai thác: Quặng được khai thác từ mỏ.
- Nghiền: Quặng được nghiền thành bột mịn.
- Phân loại: Bột mịn được phân loại theo kích thước.
- Lên men: Bột mịn được lên men bằng axit sulfuric để tạo ra lithium sulfate.
- Kết tinh: Lithium sulfate được kết tinh để tạo ra lithium sulfate khan.
- Điện phân: Lithium sulfate khan được điện phân để tạo ra lithium kim loại.
Quá trình khai thác và tinh chế Lithi có thể gây ra một số tác động môi trường như:
- Ô nhiễm nước
- Ô nhiễm đất
- Mất môi trường sống
Nhu cầu về Lithi đang ngày càng tăng do sự phát triển của pin Lithium-ion.
Điều này đang thúc đẩy các nhà nghiên cứu tìm kiếm các phương pháp khai thác và tinh chế Lithi hiệu quả hơn và thân thiện với môi trường hơn.
Vấn đề an toàn khi sử dụng Lithi
Đúng vậy, Lithi là kim loại hoạt động hóa học cao và cần lưu ý an toàn khi sử dụng.
Dưới đây là một số điều cần chú ý về an toàn:
- Nguy cơ cháy nổ:
- Lithi có thể dễ dàng bắt lửa và cháy trong không khí.
- Nước có thể phản ứng với lithi tạo ra khí hydro, khí này có thể dễ dàng bốc cháy.
- Nguy cơ bỏng da:
- Lithi có thể gây bỏng da nghiêm trọng.
- Khi tiếp xúc với da, lithi có thể tạo ra hydroxide natri, một chất kiềm mạnh có thể ăn mòn da.
- Nguy cơ độc hại:
- Lithi có thể gây độc nếu nuốt phải.
- Các triệu chứng ngộ độc lithi bao gồm buồn nôn, ói mửa, tiêu chảy, run rẩy, co giật và hôn mê.
Để đảm bảo an toàn khi sử dụng Lithi, cần thực hiện các biện pháp phòng ngừa sau:
- Luôn đeo găng tay, kính bảo hộ và quần áo bảo hộ khi làm việc với Lithi.
- Bảo quản Lithi ở nơi khô ráo, thoáng mát, tránh xa các nguồn nhiệt và nước.
- Tránh tiếp xúc trực tiếp với da và mắt.
- Nếu tiếp xúc với da, rửa sạch ngay lập tức với nhiều nước.
- Nếu nuốt phải, gọi ngay cho trung tâm cấp cứu.
Ngoài ra, cần lưu ý:
- Lithi là một loại thuốc được sử dụng để điều trị rối loạn lưỡng cực.
- Cần sử dụng thuốc theo chỉ định của bác sĩ và tuân thủ theo hướng dẫn sử dụng.
- Không tự ý sử dụng Lithi vì có thể gây ra nguy hiểm.
Dưới đây là tất cả những kiến thức cơ bản về nguyên tố Lithi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Lithi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









