Phản ứng kết tủa là một trong những hiện tượng hóa học quan trọng và thú vị, có ứng dụng rộng rãi trong nhiều lĩnh vực từ xử lý nước, hóa phân tích đến sản xuất công nghiệp. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về phản ứng kết tủa, bao gồm đặc điểm, cơ chế, ví dụ cụ thể, ứng dụng và hướng dẫn giải các bài tập liên quan.
Phản ứng kết tủa là gì?

Phản ứng kết tủa là quá trình hóa học mà trong đó hai dung dịch chứa các ion hòa tan phản ứng với nhau tạo thành một sản phẩm không tan hoặc ít tan trong dung môi, tạo thành kết tủa. Kết tủa này có thể được tách ra từ dung dịch thông qua quá trình lọc hoặc ly tâm.
Đặc điểm của phản ứng kết tủa
Phản ứng kết tủa có các đặc điểm nổi bật như sự xuất hiện của chất rắn trong một dung dịch ban đầu trong suốt, thường đi kèm với sự thay đổi màu sắc. Phản ứng này thường xảy ra nhanh chóng và có thể dễ dàng quan sát được bằng mắt thường.
Phản ứng xảy ra khi dung dịch chứa ion dương gặp dung dịch chứa ion âm tạo thành kết tủa: Đây là đặc điểm cơ bản của phản ứng kết tủa. Để phản ứng xảy ra, dung dịch cần chứa các ion có khả năng kết hợp với nhau để tạo thành chất rắn không tan.
Kết tủa có thể có nhiều màu sắc khác nhau: Màu sắc của kết tủa phụ thuộc vào cấu tạo hóa học của nó. Ví dụ, BaSO4 có màu trắng, AgCl có màu trắng, FeS có màu đen.
Phản ứng kết tủa được ứng dụng trong nhiều lĩnh vực: Phản ứng kết tủa được ứng dụng trong nhiều lĩnh vực như:
- Phân tích chất: Phân biệt các chất dựa vào màu sắc và tính tan của kết tủa.
- Điều chế chất: Điều chế các chất không tan bằng cách cho dung dịch chứa ion tương ứng phản ứng với nhau.
- Làm sạch dung dịch: Loại bỏ các tạp chất khỏi dung dịch bằng cách cho dung dịch phản ứng với chất tạo kết tủa với tạp chất.
Cơ chế của phản ứng kết tủa
Giai đoạn hình thành hạt
- Khi hai dung dịch chứa các ion có khả năng kết hợp với nhau để tạo thành chất rắn không tan được trộn lẫn, các ion này sẽ bắt đầu tương tác với nhau.
- Lúc đầu, các ion sẽ tạo thành các cặp ion.
- Các cặp ion này tiếp tục liên kết với nhau để tạo thành các cụm ion.
- Khi kích thước của cụm ion đạt đến một giá trị nhất định, nó sẽ trở thành hạt kết tủa.
Giai đoạn phát triển hạt
- Các hạt kết tủa mới hình thành sẽ tiếp tục phát triển bằng cách liên kết với các ion trong dung dịch.
- Quá trình này sẽ tiếp tục cho đến khi tất cả các ion trong dung dịch được sử dụng hết hoặc cho đến khi đạt đến trạng thái cân bằng.
Yếu tố ảnh hưởng đến tốc độ hình thành và phát triển hạt kết tủa
- Nồng độ dung dịch: Nồng độ dung dịch càng cao, tốc độ hình thành và phát triển hạt kết tủa càng nhanh.
- Nhiệt độ: Nhiệt độ càng cao, tốc độ hình thành và phát triển hạt kết tủa càng nhanh.
- Độ pH: Độ pH của dung dịch ảnh hưởng đến khả năng tan của các ion, do đó ảnh hưởng đến tốc độ hình thành và phát triển hạt kết tủa.
- Chất ổn định: Chất ổn định là chất có thể làm chậm quá trình hình thành và phát triển hạt kết tủa.
Ảnh hưởng của kích thước hạt kết tủa
- Kích thước hạt kết tủa ảnh hưởng đến nhiều tính chất của nó như độ mịn, độ bền, khả năng lọc.
- Hạt kết tủa có kích thước nhỏ thường có độ mịn cao, độ bền thấp, khả năng lọc tốt.
- Hạt kết tủa có kích thước lớn thường có độ mịn thấp, độ bền cao, khả năng lọc kém.
Ví dụ về phản ứng kết tủa
Phản ứng trao đổi ion
- Phản ứng giữa dung dịch BaCl2 và dung dịch Na2SO4:
BaCl2(aq) + Na2SO4(aq) → BaSO4(s)↓ + 2NaCl(aq)
- Phản ứng giữa dung dịch AgNO3 và dung dịch NaCl làm tạo thành kết tủa của clorua bạc (AgCl):
AgNO3(aq) + NaCl(aq) → AgCl(s)↓ + NaNO3(aq)
Phản ứng thủy phân
- Phản ứng thủy phân của muối amoniac:
NH4Cl(aq) + H2O(l) ⇌ NH4OH(aq) + HCl(aq)
NH4OH(aq) + H2O(l) ⇌ NH3(g)↑ + H2O(l) + H+(aq)
- Phản ứng thủy phân của muối cacbonat:
Na2CO3(aq) + H2O(l) ⇌ 2NaHCO3(aq)
NaHCO3(aq) + H2O(l) ⇌ NaOH(aq) + CO2(g)↑ + H2O(l)
Phản ứng oxy hóa khử
- Phản ứng giữa dung dịch KMnO4 và dung dịch FeSO4 làm tạo ra kết tủa màu nâu đỏ của manganese dioxide (MnO2):
2KMnO4(aq) + 10FeSO4(aq) + 8H2SO4(aq) → 5Fe2(SO4)3(aq) + K2SO4(aq) + 2MnSO4(aq) + 8H2O(l)
- Phản ứng giữa dung dịch NaOH và dung dịch CuSO4 làm tạo ra kết tủa màu xanh lá cây của hydroxit đồng II (Cu(OH)2):
2NaOH(aq) + CuSO4(aq) → Cu(OH)2(s)↓ + Na2SO4(aq)
Ứng dụng của phản ứng kết tủa
Phân tích chất
- Phản ứng kết tủa được sử dụng để nhận biết và xác định các chất. Ví dụ:
- Dùng dung dịch BaCl2 để nhận biết dung dịch Na2SO4.
- Dùng dung dịch AgNO3 để nhận biết dung dịch NaCl.
- Phản ứng kết tủa cũng được sử dụng để định lượng các chất. Ví dụ:
- Định lượng hàm lượng Ba2+ trong dung dịch bằng cách cho dung dịch Na2SO4 dư vào.
- Định lượng hàm lượng Cl- trong dung dịch bằng cách cho dung dịch AgNO3 dư vào.
Điều chế chất
- Phản ứng kết tủa được sử dụng để điều chế các chất không tan. Ví dụ:
- Điều chế BaSO4 bằng cách cho dung dịch BaCl2 tác dụng với dung dịch Na2SO4.
- Điều chế AgCl bằng cách cho dung dịch AgNO3 tác dụng với dung dịch NaCl.
Làm sạch dung dịch
- Phản ứng kết tủa được sử dụng để loại bỏ các tạp chất khỏi dung dịch. Ví dụ:
- Loại bỏ tạp chất Fe2+ khỏi dung dịch CuSO4 bằng cách cho dung dịch NaOH vào.
- Loại bỏ tạp chất SO42- khỏi dung dịch BaCl2 bằng cách cho dung dịch Na2CO3 vào.
Một số ứng dụng khác
- Phản ứng kết tủa được sử dụng trong sản xuất sơn, mực in, giấy, cao su, …
- Phản ứng kết tủa cũng được sử dụng trong xử lý nước thải.
Các bước phản ứng kết tủa
Hình thành hạt
- Khi hai dung dịch chứa các ion có khả năng kết hợp với nhau để tạo thành chất rắn không tan được trộn lẫn, các ion này sẽ bắt đầu tương tác với nhau.
- Lúc đầu, các ion sẽ tạo thành các cặp ion.
- Các cặp ion này tiếp tục liên kết với nhau để tạo thành các cụm ion.
- Khi kích thước của cụm ion đạt đến một giá trị nhất định, nó sẽ trở thành hạt kết tủa.
Phát triển hạt
- Các hạt kết tủa mới hình thành sẽ tiếp tục phát triển bằng cách liên kết với các ion trong dung dịch.
- Quá trình này sẽ tiếp tục cho đến khi tất cả các ion trong dung dịch được sử dụng hết hoặc cho đến khi đạt đến trạng thái cân bằng.
Lắng đọng
- Các hạt kết tủa có kích thước đủ lớn sẽ lắng đọng xuống đáy dung dịch do trọng lực.
- Quá trình lắng đọng có thể được đẩy nhanh bằng cách ly tâm.
Lọc
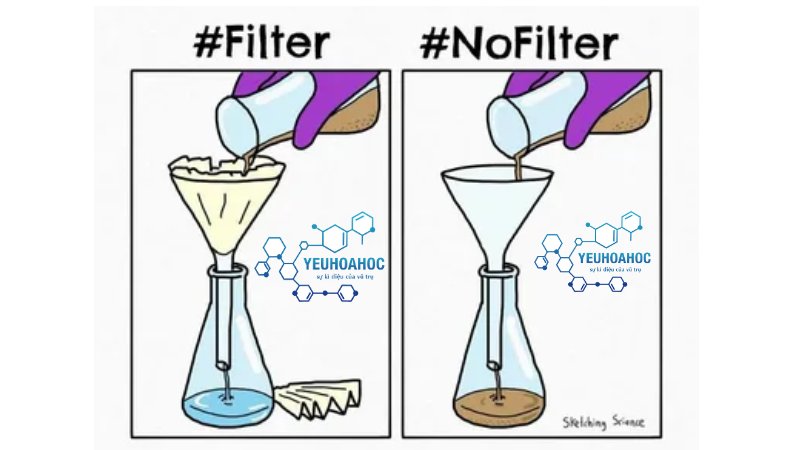
- Các hạt kết tủa có thể được thu thập bằng cách lọc dung dịch sau phản ứng.
- Có thể sử dụng nhiều phương pháp lọc khác nhau như lọc bằng giấy lọc, lọc bằng phễu Büchner, …
Rửa
- Các hạt kết tủa thu được cần được rửa sạch để loại bỏ các tạp chất.
- Có thể sử dụng nước cất hoặc dung dịch thích hợp để rửa.
Sấy khô
- Các hạt kết tủa sau khi rửa cần được sấy khô để thu được sản phẩm cuối cùng.
- Có thể sử dụng nhiều phương pháp sấy khô khác nhau như sấy bằng tủ sấy, sấy bằng đèn sấy, …
Cách giải bài tập phản ứng kết tủa
Bước 1: Viết phương trình phản ứng xảy ra.
Bước 2: Xác định chất tạo kết tủa.
Bước 3: Tính toán số mol của các chất tham gia phản ứng.
Bước 4: So sánh số mol của các chất tham gia phản ứng với tỉ lệ mol trong phương trình phản ứng.
Bước 5: Xác định chất phản ứng hết, chất dư.
Bước 6: Tính toán số mol của chất kết tủa.
Bước 7: Viết các phương trình phản ứng trung hòa (nếu có).
Bước 8: Tính toán khối lượng kết tủa.
Ví dụ:
Cho 100 ml dung dịch BaCl2 1M tác dụng với 200 ml dung dịch Na2SO4 0,5M. Tính khối lượng kết tủa thu được.
Giải:
Bước 1: Viết phương trình phản ứng xảy ra.
BaCl2 + Na2SO4 -> BaSO4↓ + 2NaCl
Bước 2: Xác định chất tạo kết tủa.
Chất tạo kết tủa là BaSO4.
Bước 3: Tính toán số mol của các chất tham gia phản ứng.
- n(BaCl2) = C(BaCl2) * V(BaCl2) = 1M * 0,1 lít = 0,1 mol
- n(Na2SO4) = C(Na2SO4) * V(Na2SO4) = 0,5M * 0,2 lít = 0,1 mol
Bước 4: So sánh số mol của các chất tham gia phản ứng với tỉ lệ mol trong phương trình phản ứng.
- Tỉ lệ mol trong phương trình phản ứng: n(BaCl2) : n(Na2SO4) = 1 : 1
- Tỉ lệ mol của các chất tham gia phản ứng: n(BaCl2) : n(Na2SO4) = 0,1 : 0,1 = 1 : 1
Bước 5: Xác định chất phản ứng hết, chất dư.
Vì tỉ lệ mol của các chất tham gia phản ứng bằng với tỉ lệ mol trong phương trình phản ứng nên cả BaCl2 và Na2SO4 đều phản ứng hết.
Bước 6: Tính toán số mol của chất kết tủa.
n(BaSO4) = n(BaCl2) = n(Na2SO4) = 0,1 mol
Bước 7: Viết các phương trình phản ứng trung hòa (nếu có).
Không có phản ứng trung hòa trong ví dụ này.
Bước 8: Tính toán khối lượng kết tủa.
m(BaSO4) = n(BaSO4) * M(BaSO4) = 0,1 mol * 233 g/mol = 23,3 g
Kết quả: Khối lượng kết tủa thu được là 23,3 g.
Các dạng bài tập của phản ứng kết tủa
Xác định sản phẩm của phản ứng kết tủa
Đề bài 1: Khi cho dung dịch bari clorua (BaCl2) tác dụng với dung dịch natri sunfat (Na2SO4), sản phẩm kết tủa là bari sulfat (BaSO4).
Phương trình phản ứng:
BaCl2(aq) + Na2SO4(aq) → BaSO4(s)↓ + 2NaCl(aq)
Giải thích:
- BaCl2 và Na2SO4 đều là những muối tan trong nước.
- Khi dung dịch BaCl2 và Na2SO4 được trộn lẫn, các ion Ba2+ và SO42- trong dung dịch sẽ kết hợp với nhau để tạo thành BaSO4, một chất rắn không tan trong nước.
- BaSO4 có màu trắng và không tan trong nước, do đó nó sẽ lắng đọng xuống đáy dung dịch dưới dạng kết tủa.
Ứng dụng:
Phản ứng giữa BaCl2 và Na2SO4 được ứng dụng trong:
- Phân tích chất: Dùng để nhận biết và xác định các ion Ba2+ và SO42-.
- Điều chế chất: Dùng để điều chế BaSO4, một chất có nhiều ứng dụng trong công nghiệp.
- Làm sạch dung dịch: Dùng để loại bỏ các ion Ba2+ và SO42- khỏi dung dịch.
Lưu ý:
- Phản ứng giữa BaCl2 và Na2SO4 xảy ra nhanh và hoàn toàn.
- BaSO4 là một chất rắn không tan trong nước, axit và bazơ loãng.
Tính khối lượng kết tủa
Đề bài 2: Khi cho 200ml dung dịch AgNO3 0.1M tác dụng với 300ml dung dịch NaCl 0.1M, tính khối lượng kết tủa AgCl tạo thành.
Lời giải
- Xác định phương trình phản ứng:
- Phương trình phản ứng cân bằng:
AgNO3(aq) + NaCl(aq) → AgCl(s)↓ + NaNO3(aq)
- Loại phản ứng: trao đổi ion.
- Viết biểu thức tính số mol các chất:
- Số mol AgNO3 ban đầu:
nAgNO3 = CAgNO3 * VAgNO3 = 0,1 * 0,2 = 0,02 mol
- Số mol NaCl ban đầu:
nNaCl = CNaCl * VNaCl = 0,1 * 0,3 = 0,03 mol
- Biểu thức tính số mol AgCl:
nAgCl = min(nAgNO3, nNaCl)
- Giải bài toán:
- So sánh số mol AgNO3 và NaCl:
nAgNO3 = 0,02 mol < nNaCl = 0,03 mol
- Vậy AgNO3 phản ứng hết, NaCl dư.
- Tính số mol AgCl:
nAgCl = min(nAgNO3, nNaCl) = 0,02 mol
- Khối lượng AgCl:
mAgCl = nAgCl * MAgCl = 0,02 * 143,5 = 2,87 g
- Viết kết quả:
- Khối lượng của kết tủa AgCl tạo ra là 2,87 gram.
Xác định nồng độ sau phản ứng
Đề bài 3: Khi trộn 50ml dung dịch Ca(NO3)2 0.2M với 100ml dung dịch Na2CO3 0.1M, hãy xác định nồng độ của tất cả các ion còn lại trong dung dịch sau khi kết tủa CaCO3 đã được lọc ra.
Lời giải:
Xác định phương trình phản ứng:
- Phương trình phản ứng cân bằng:
Ca(NO3)2(aq) + Na2CO3(aq) → CaCO3(s)↓ + 2NaNO3(aq)
- Loại phản ứng: trao đổi ion.
- Viết biểu thức tính số mol các chất:
- Số mol Ca(NO3)2 ban đầu:
nCa(NO3)2 = CCa(NO3)2 * VCa(NO3)2 = 0,2 * 0,05 = 0,01 mol
- Số mol Na2CO3 ban đầu:
nNa2CO3 = CNa2CO3 * VNa2CO3 = 0,1 * 0,1 = 0,01 mol
- Biểu thức tính số mol CaCO3:
nCaCO3 = min(nCa(NO3)2, nNa2CO3)
- Giải bài toán:
- So sánh số mol Ca(NO3)2 và Na2CO3:
nCa(NO3)2 = nNa2CO3 = 0,01 mol
- Vậy Ca(NO3)2 và Na2CO3 phản ứng hết.
- Tính số mol CaCO3:
nCaCO3 = min(nCa(NO3)2, nNa2CO3) = 0,01 mol
- Nồng độ mol của các ion trong dung dịch sau khi phản ứng đã được xác định:
NO3-:
CNO3- = (nNO3- / V) = (2 * nCaCO3 + nNa2CO3) / (VCa(NO3)2 + VNa2CO3) = (2 * 0,01 + 0,01) / (0,05 + 0,1) = 0,08 M
Nồng độ ion Na+:
CNa+ = (nNa+ / V) = (nNa2CO3 + 2 * nCa(NO3)2) / (VCa(NO3)2 + VNa2CO3) = (0,01 + 2 * 0,01) / (0,05 + 0,1) = 0,12 M
nồng độ ion Ca2+:
CCa2+ = (nCa2+ / V) = (nCa(NO3)2 – nCaCO3) / (VCa(NO3)2 + VNa2CO3) = (0,01 – 0,01) / (0,05 + 0,1) = 0 M
- Viết kết quả:
- Nồng độ của các ion trong dung dịch sau khi phản ứng:
- NO3-: 0,08 M
- Na+: 0,12 M
- Ca2+: 0 M
Phân tích độ tan
Đề bài 4: Cho biết độ tan của PbI2 là 0.077g/100g nước ở 20°C. Tính nồng độ bão hòa của PbI2 ở nhiệt độ này.
Tính nồng độ bão hòa của PbI2 ở 20°C
Xác định nồng độ mol của PbI2
- Độ tan của PbI2 ở 20°C là 0,077g/100g nước.
- Khối lượng mol của PbI2 là 461,02 g/mol.
Nồng độ mol của PbI2:
C_PbI2 = (Độ tan / Khối lượng mol) * 1000
= (0,077 g / 100 g) * (1000 g/kg) / 461,02 g/mol
= 1,67 * 10^(-3) mol/kg
Chuyển đổi nồng độ mol sang đơn vị khác
- Nồng độ mol/L:
C_PbI2 (mol/L) = C_PbI2 (mol/kg) * D_nước
= 1,67 * 10^(-3) mol/kg * 1 kg/L
= 1,67 * 10^(-3) mol/L
- Nồng độ phần trăm:
CPbI2 (%) = (CPbI2 (mol/L) * MPbI2) / 10
= (1,67 * 10^(-3) mol/L * 461,02 g/mol) / 10
= 0,077 g/L
Kết quả
- Nồng độ bão hòa của PbI2 ở 20°C là:
- 1,67 * 10^(-3) mol/L
- 0,077 g/L
Bảng thống kê một số kết tủa hay và màu sắc đẹp
| Tên kết tủa | Công thức hóa học | Màu sắc |
| Bari sulfat | BaSO4 | Trắng |
| Chì(II) sulfide | PbS | Đen |
| Chì(II) iodide | PbI2 | Vàng chanh |
| Đồng(II) hydroxide | Cu(OH)2 | Xanh lam nhạt |
| Đồng(II) ferrocyanide | Cu2Fe(CN)6 | Nâu đỏ |
| Ferric hydroxide | Fe(OH)3 | Nâu đỏ |
| Ferrous hydroxide | Fe(OH)2 | Xanh lá cây |
| Magnesi hydroxide | Mg(OH)2 | Trắng |
| Mangan(II) hydroxide | Mn(OH)2 | Trắng |
| Nickel(II) hydroxide | Ni(OH)2 | Xanh lục |
| Sắt(III) sulfide | Fe2S3 | Đen |
| Silver chloride | AgCl | Trắng |
| Silver chromate | Ag2CrO4 | Đỏ cam |
| Silver iodide | AgI | Vàng |
| Zinc hydroxide | Zn(OH)2 | Trắng |









