Nước là một trong những chất quan trọng và phổ biến nhất trên Trái Đất, chiếm phần lớn diện tích hành tinh chúng ta. Không chỉ là yếu tố cần thiết cho sự sống, nước còn là một hợp chất quan trọng trong nhiều phản ứng hóa học. Trong hóa học, nước có công thức hóa học đơn giản nhưng vô cùng đặc biệt – H2O. Hợp chất này đóng vai trò quan trọng trong vô số quá trình tự nhiên và công nghiệp, từ các phản ứng hóa học cơ bản đến những quy trình phức tạp trong ngành công nghiệp.
Công thức hóa học của nước – H2O
Công thức hóa học của nước là H2O, nghĩa là mỗi phân tử nước được tạo thành từ hai nguyên tử hydro (H) và một nguyên tử oxy (O). Đây là một hợp chất phân tử thuộc loại hợp chất phân cực, trong đó nguyên tử oxy có độ âm điện lớn hơn nhiều so với hydro, dẫn đến sự phân bố điện tích không đều. Điều này làm cho nước có nhiều tính chất hóa học và vật lý đặc biệt.
- Nguyên tử hydro (H): Hai nguyên tử hydro trong phân tử nước được liên kết với nguyên tử oxy thông qua liên kết cộng hóa trị.
- Nguyên tử oxy (O): Oxy có khả năng hút electron mạnh hơn hydro, khiến cho liên kết O-H trở thành liên kết phân cực. Kết quả là đầu chứa nguyên tử oxy của phân tử nước có điện tích âm nhẹ, trong khi đầu chứa hydro có điện tích dương nhẹ.
Cấu trúc phân tử H2O tạo ra một góc giữa hai liên kết H-O khoảng 104,5 độ, góp phần tạo nên những tính chất đặc biệt của nước như khả năng tạo liên kết hydro và tính phân cực cao.
Tính chất hóa học của nước
Nước có những tính chất hóa học độc đáo, khiến nó đóng vai trò quan trọng trong nhiều phản ứng hóa học.
Phản ứng phân ly của nước
Trong điều kiện tự nhiên, nước có khả năng phân ly yếu thành ion hydroxit (OH⁻) và ion hydro (H⁺). Phản ứng này có ý nghĩa quan trọng trong việc duy trì độ pH trong môi trường tự nhiên và trong nhiều quá trình hóa học:
\(H_2O \leftrightarrow H^+ + OH^-\)
Phản ứng phân ly này khiến nước trở thành một chất lưỡng tính, có thể đóng vai trò là axit hoặc bazơ trong các phản ứng axit-bazơ.
Phản ứng với kim loại kiềm
Nước phản ứng mạnh với các kim loại kiềm như natri (Na), kali (K), tạo ra kiềm và giải phóng khí hydro (H2). Đây là một phản ứng mạnh và sinh nhiệt. Ví dụ, khi natri phản ứng với nước:
\(2Na + 2H_2O \rightarrow 2NaOH + H_2\)
Phản ứng này giải phóng năng lượng và có thể dẫn đến cháy nổ nếu không được kiểm soát.
Phản ứng với oxit bazơ
Nước phản ứng với oxit bazơ để tạo ra bazơ tương ứng. Phản ứng này thường xảy ra với các oxit của kim loại kiềm và kiềm thổ. Ví dụ, khi oxit canxi (CaO), hay còn gọi là vôi sống, phản ứng với nước, nó tạo ra canxi hydroxit (Ca(OH)2):
\(CaO + H_2O \rightarrow Ca(OH)_2\)
Phản ứng này là cơ sở để sản xuất vôi tôi, một vật liệu quan trọng trong xây dựng.
Phản ứng với oxit axit
Nước cũng phản ứng với oxit axit để tạo ra axit tương ứng. Ví dụ, khi khí carbon dioxide (CO2) hòa tan trong nước, nó tạo thành axit cacbonic (H2CO3):
\(CO_2 + H_2O \rightarrow H_2CO_3\)
Tương tự, khi lưu huỳnh dioxit (SO2) phản ứng với nước, nó tạo ra axit sunfurơ (H2SO3), một chất gây ô nhiễm phổ biến trong nước mưa axit.
Phản ứng thủy phân
Nước tham gia vào quá trình thủy phân, tức là phân cắt liên kết trong một hợp chất bằng cách thêm nước. Phản ứng này quan trọng trong sinh hóa và công nghiệp hóa chất, ví dụ như thủy phân este thành axit và rượu dưới tác dụng của axit hoặc bazơ:
\(RCOOR’ + H_2O \rightarrow RCOOH + R’OH\)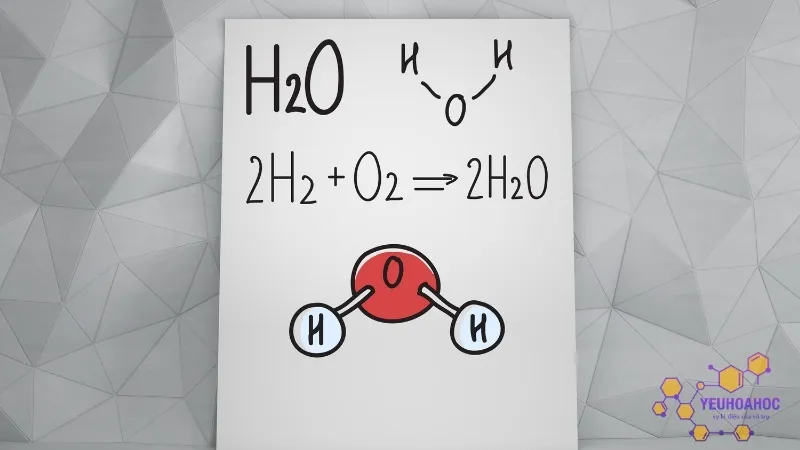
Tính chất vật lý của nước
Ngoài các tính chất hóa học, nước còn có nhiều tính chất vật lý đặc biệt.
Liên kết hydro
Nhờ cấu trúc phân tử đặc trưng, nước có khả năng tạo ra liên kết hydro giữa các phân tử nước với nhau. Điều này giải thích vì sao nước có điểm sôi và điểm nóng chảy cao hơn so với các hợp chất có cùng khối lượng phân tử, và cũng là nguyên nhân khiến nước tồn tại dưới dạng lỏng ở nhiệt độ phòng.
Nhiệt dung riêng cao
Nước có nhiệt dung riêng cao, tức là nó có khả năng hấp thụ nhiệt lượng lớn mà không tăng nhiệt độ quá nhanh. Đây là lý do tại sao nước có khả năng điều hòa nhiệt độ trong môi trường tự nhiên và cơ thể sống.
Khả năng hòa tan
Nước là một dung môi tuyệt vời, thường được gọi là “dung môi vạn năng”, vì nó có thể hòa tan nhiều chất khác nhau, đặc biệt là các hợp chất ion và phân tử phân cực. Điều này có ý nghĩa quan trọng trong các quá trình hóa học và sinh hóa, chẳng hạn như trong cơ thể con người, nước giúp vận chuyển chất dinh dưỡng và loại bỏ các chất thải.
Các phản ứng hóa học quan trọng của nước
Nước tham gia vào nhiều phản ứng hóa học quan trọng trong tự nhiên và công nghiệp. Dưới đây là một số ví dụ nổi bật.
Quá trình quang hợp
Trong quá trình quang hợp của cây xanh, nước đóng vai trò quan trọng khi tham gia vào phản ứng với khí CO2 dưới tác dụng của ánh sáng mặt trời để tạo ra glucose và oxy:
\(6CO_2 + 6H_2O + \text{ánh sáng} \rightarrow C_6H_{12}O_6 + 6O_2\)
Phản ứng này giúp cây xanh tổng hợp chất hữu cơ và giải phóng oxy, cung cấp năng lượng cho toàn bộ chuỗi thức ăn.
Phản ứng oxy hóa khử
Nước là môi trường trung gian trong nhiều phản ứng oxy hóa khử. Một ví dụ điển hình là phản ứng giữa nước và clo trong quá trình khử trùng:
\(Cl_2 + H_2O \leftrightarrow HCl + HClO\)
Trong phản ứng này, nước giúp phân ly clo để tạo thành axit clohydric (HCl) và axit hypoclorơ (HClO), hai chất có khả năng diệt khuẩn mạnh.
Điện phân nước
Nước có thể bị điện phân để tạo ra khí hydro và khí oxy – một phản ứng quan trọng trong việc sản xuất hydro làm nhiên liệu sạch:
\(H_2O \xrightarrow{\text{điện}} 2H_2 + O_2\)
Phản ứng này được thực hiện trong các bể điện phân và đòi hỏi năng lượng điện để tách phân tử nước thành các thành phần nguyên tố của nó.
Ứng dụng của nước trong công nghiệp hóa học
Trong công nghiệp, nước không chỉ là dung môi mà còn là chất phản ứng và chất làm mát trong nhiều quy trình sản xuất.
Sản xuất axit
Nước đóng vai trò quan trọng trong sản xuất axit như axit sunfuric (H2SO4) thông qua quá trình hydrat hóa SO3:
\(SO_3 + H_2O \rightarrow H_2SO_4\)
Axit sunfuric là một trong những hóa chất quan trọng nhất trong công nghiệp, được sử dụng để sản xuất phân bón, thuốc nhuộm và nhiều sản phẩm khác.
Sản xuất hydro
Quá trình điện phân nước được sử dụng để sản xuất hydro trong ngành công nghiệp năng lượng. Hydro sau đó có thể được sử dụng làm nhiên liệu sạch trong các loại pin nhiên liệu hoặc trong các phản ứng tổng hợp hóa học.
Tổng kết
Công thức hóa học của nước H2O là một trong những hợp chất đơn giản nhất nhưng lại có vai trò vô cùng quan trọng trong đời sống và các ngành công nghiệp. Nước không chỉ tham gia vào nhiều phản ứng hóa học cơ bản mà còn đóng vai trò là dung môi và chất phản ứng trong vô số quá trình công nghiệp. Từ phản ứng quang hợp trong tự nhiên đến điện phân nước để sản xuất hydro, nước là một hợp chất thiết yếu trong cả sinh học và hóa học.
Hy vọng rằng qua bài viết này, bạn đã hiểu rõ hơn về công thức hóa học của nước cũng như các tính chất và phản ứng quan trọng của nó. Nước không chỉ đơn thuần là một chất lỏng mà chúng ta uống hàng ngày, mà còn là nguồn cảm hứng vô tận trong thế giới hóa học đầy kỳ diệu.









