Cân bằng hóa học là một khái niệm trung tâm trong hóa học, giúp giải thích sự ổn định của các phản ứng hóa học trong môi trường tự nhiên và công nghiệp. Nó xác định cách các phản ứng điều chỉnh theo điều kiện bên ngoài và đạt đến trạng thái cân bằng. Khám cùng chúng tôi phá nguyên tắc cân bằng hóa học và ảnh hưởng của nó đến các phản ứng hóa học. Hiểu cách thay đổi điều kiện có thể làm chệch cân bằng và ứng dụng của nó trong công nghiệp.
Khái niệm và các yếu tố ảnh hưởng của cân bằng hóa học
Định nghĩa
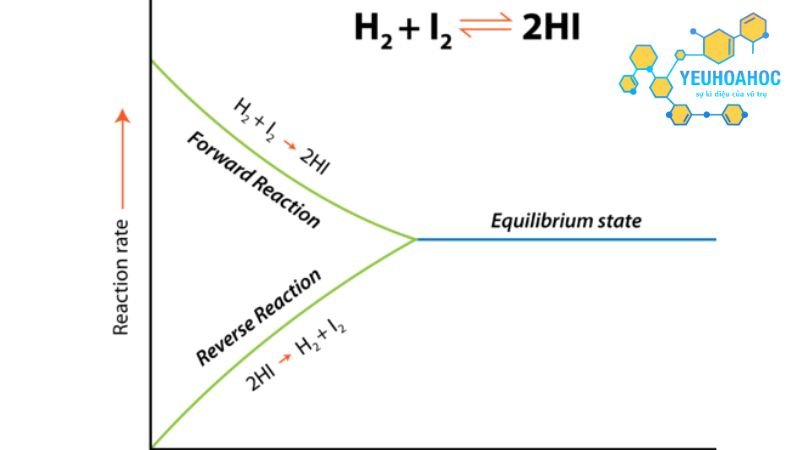
Cân bằng hóa học là trạng thái động của một phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Ở trạng thái này, nồng độ của các chất phản ứng và sản phẩm không thay đổi theo thời gian. Tuy nhiên, chúng không bằng nhau mà có tỷ lệ xác định.
Giải thích
- Phản ứng thuận nghịch: Đây là loại phản ứng có khả năng diễn ra theo hai hướng: từ chất tham gia phản ứng chuyển thành sản phẩm và từ sản phẩm trở lại thành chất phản ứng
- Tốc độ phản ứng: Là đại lượng thể hiện số lượng chất phản ứng hoặc sản phẩm được tạo thành trong một đơn vị thời gian.
- Cân bằng động: Cân bằng hóa học là cân bằng động, nghĩa là các chất phản ứng và sản phẩm liên tục chuyển hóa lẫn nhau nhưng với tốc độ bằng nhau nên nồng độ của chúng không đổi.
Một vài yếu tố ảnh hưởng đến cân bằng hóa học
Nhiệt độ:
- Nhiệt độ tăng, tốc độ phản ứng tăng theo nguyên tắc Van’t Hoff.
- Khi phản ứng thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
- Khi phản ứng tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
Áp suất:
- Áp suất tăng, cân bằng chuyển dịch theo chiều giảm thể tích.
- Áp suất giảm, cân bằng chuyển dịch theo chiều tăng thể tích.
Nồng độ:
- Nồng độ chất phản ứng tăng, cân bằng chuyển dịch theo chiều thuận.
- Nồng độ chất sản phẩm tăng, cân bằng chuyển dịch theo chiều nghịch.
Ngoài ra, một số yếu tố khác cũng có thể ảnh hưởng đến cân bằng hóa học như chất xúc tác, thể tích hệ,…
Các loại cân bằng hóa học
Cân bằng hóa học được chia thành các loại chính dựa trên tỷ lệ nồng độ các chất tại trạng thái cân bằng:
Cân bằng đồng thuận
Đặc điểm: Nồng độ các chất phản ứng và sản phẩm xấp xỉ bằng nhau.
Nguyên tắc:
- Hằng số cân bằng (K) có giá trị lớn (K >> 1).
- Phản ứng diễn ra mạnh theo chiều thuận.
- Gần như tất cả các chất tham gia phản ứng chuyển hóa thành sản phẩm.
Cân bằng không đồng thuận
Đặc điểm: Nồng độ các chất phản ứng và sản phẩm khác biệt nhau rõ rệt.
Nguyên tắc:
- Hằng số cân bằng (K) có giá trị nhỏ (K << 1).
- Phản ứng diễn ra yếu theo chiều thuận.
- Chỉ có một lượng nhỏ chất tham gia phản ứng chuyển hóa thành sản phẩm.
Cân bằng di chuyển
Đặc điểm: Nồng độ các chất phản ứng và sản phẩm thay đổi theo thời gian nhưng hướng đến trạng thái cân bằng.
Nguyên tắc:
- Hằng số cân bằng (K) có giá trị hữu hạn.
- Phản ứng diễn ra theo cả hai chiều thuận và nghịch với tốc độ không bằng nhau.
- Nồng độ các chất phản ứng và sản phẩm tăng/giảm cho đến khi đạt cân bằng.
Ví dụ: Phản ứng este hóa axit axetic với etanol.
Lưu ý:
- Cả ba loại cân bằng hóa học đều là những trạng thái động.
- Loại cân bằng hóa học được thiết lập phụ thuộc vào nhiều yếu tố như bản chất phản ứng, điều kiện phản ứng,…
Phân biệt các loại cân bằng hóa học
| Loại cân bằng | Đặc điểm | Ví dụ |
| Cân bằng đồng thuận | – Phản ứng thuận nghịch không còn xảy ra. – Hệ thống đạt trạng thái cân bằng hoàn toàn. |
|
| Cân bằng không đồng thuận | – Phản ứng thuận nghịch tiếp tục xảy ra nhưng với tốc độ bằng nhau. – Hệ thống đạt trạng thái cân bằng không hoàn toàn. |
|
| Cân bằng di chuyển | – Các chất tham gia phản ứng liên tục biến đổi thành sản phẩm và ngược lại. – Tốc độ phản ứng thuận và nghịch như nhau. – Nồng độ các chất tham gia phản ứng và sản phẩm có thể thay đổi theo thời gian. | Phản ứng thủy phân este: CH3COOC2H5 + H2O ⇌ CH3COOH + C2H5OH |
Ý nghĩa của các loại cân bằng hóa học
Hiểu rõ các loại cân bằng hóa học giúp ta:
- Dự đoán chiều chuyển dịch của cân bằng khi tác động các yếu tố bên ngoài (nhiệt độ, áp suất, nồng độ,…).
- Tối ưu hóa các quá trình sản xuất hóa học, nâng cao hiệu suất và giảm thiểu ô nhiễm môi trường.
Ví dụ về cân bằng hóa học trong thực tế
Phản ứng trung hòa axit – bazơ
- Ví dụ: Khi cho dung dịch axit axetic (CH3COOH) tác dụng với dung dịch natri hiđroxit (NaOH), xảy ra phản ứng trung hòa:
CH3COOH + NaOH → CH3COONa + H2O
- Giải thích:
- Phản ứng này là thuận nghịch, nghĩa là CH3COONa và H2O có thể phân hủy thành CH3COOH và NaOH.
- Khi trộn hai dung dịch, nồng độ ban đầu của CH3COOH và NaOH cao, phản ứng diễn ra mạnh theo chiều thuận.
- Khi nồng độ CH3COOH và NaOH giảm, nồng độ CH3COONa và H2O tăng, phản ứng diễn ra theo chiều nghịch.
- Cuối cùng, hệ thống đạt đến cân bằng, khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Lúc này, nồng độ của các chất không đổi theo thời gian.
Phản ứng phân hủy
- Ví dụ: Phân hủy canxi cacbonat (CaCO3) thành canxi oxit (CaO) và cacbon đioxit (CO2) khi nung nóng:
CaCO3 → CaO + CO2
- Giải thích:
- Phản ứng này cũng thuận nghịch, nghĩa là CaO và CO2 có thể tác dụng với nhau tạo thành CaCO3.
- Khi nung nóng CaCO3, do nhiệt độ tăng, phản ứng diễn ra mạnh theo chiều thuận.
- Khi một phần CaCO3 phân hủy, nồng độ CO2 tăng, phản ứng diễn ra theo chiều nghịch.
- Ở một nhiệt độ nhất định, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch, hệ thống đạt đến cân bằng. Lúc này, lượng CaCO3 phân hủy giới hạn và tỷ lệ giữa CaCO3, CaO và CO2 không đổi.
Phản ứng este hóa
- Ví dụ: Phản ứng giữa axit axetic (CH3COOH) và etanol (C2H5OH) tạo thành este etyl axetat (CH3COOC2H5) và nước (H2O) được xúc tác bởi axit sunfuric (H2SO4):
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
- Giải thích:
- Phản ứng này thuận nghịch, nghĩa là este etyl axetat và nước có thể phân hủy thành axit axetic và etanol.
- Khi trộn các chất ban đầu, nồng độ CH3COOH và C2H5OH cao, phản ứng diễn ra theo chiều thuận.
- Khi nồng độ CH3COOH và C2H5OH giảm, nồng độ CH3COOC2H5 và H2O tăng, phản ứng diễn ra theo chiều nghịch.
- Dưới tác dụng của axit sunfuric (xúc tác), tốc độ phản ứng tăng và hệ thống đạt đến cân bằng nhanh hơn. Lúc này, tỷ lệ giữa các chất không đổi theo thời gian.
Ứng dụng của cân bằng hóa học trong công nghiệp và sản xuất hóa chất
Sản xuất amoniac
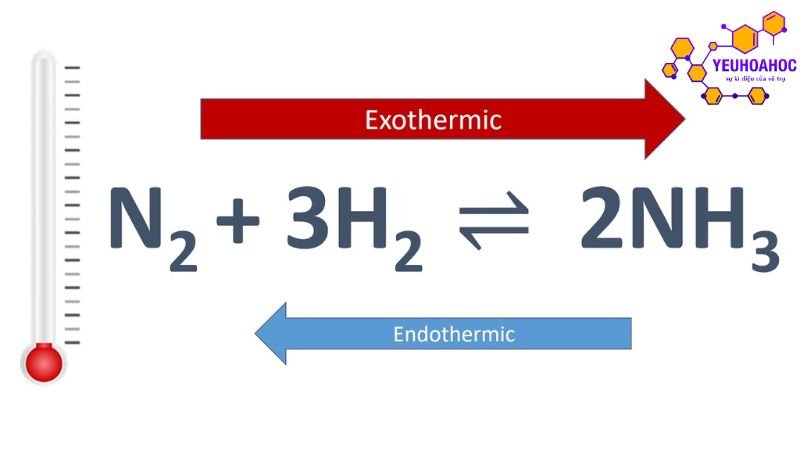
- Phản ứng tổng hợp amoniac từ nitơ và hiđrô (phản ứng Haber-Bosch) là một trong những phản ứng hóa học quan trọng nhất trong công nghiệp:
N2 + 3H2 ⇌ 2NH3
- Phản ứng này thuận nghịch và tỏa nhiệt.
- Ở điều kiện nhiệt độ cao (khoảng 450°C) và áp suất cao (khoảng 200 atm), hằng số cân bằng (K) lớn, phản ứng chuyển dịch theo chiều thuận tạo ra amoniac.
- Chất xúc tác được sử dụng để tăng tốc độ phản ứng và giảm nhiệt độ cần thiết cho phản ứng.
Sản xuất axit sunfuric
- Quá trình sản xuất axit sunfuric bao gồm hai giai đoạn chính:
- Đốt cháy lưu huỳnh (S) tạo ra khí lưu huỳnh đioxit (SO2): S + O2 ⇌ SO2
- Oxy hóa SO2 thành SO3 bằng cách sử dụng chất xúc tác vanadi pentoxit (V2O5): 2SO2 + O2 ⇌ 2SO3
- Cả hai phản ứng này đều thuận nghịch và tỏa nhiệt.
- Điều kiện (nhiệt độ, áp suất) được điều chỉnh để phản ứng chuyển dịch theo chiều thuận tạo ra SO3.
- SO3 sau đó được hòa tan trong nước để tạo thành axit sunfuric.
Luyện kim
- Trong luyện kim, cân bằng hóa học được sử dụng để loại bỏ tạp chất khỏi kim loại. Ví dụ, trong quá trình luyện thép, khí CO được sử dụng để khử oxit sắt (FeO) thành kim loại sắt (Fe):
FeO + CO ⇌ Fe + CO2
- Phản ứng này thuận nghịch và tỏa nhiệt.
- Điều kiện (nhiệt độ, áp suất) được điều chỉnh để phản ứng chuyển dịch theo chiều thuận loại bỏ oxit sắt và tạo ra kim loại sắt tinh khiết.
Sản xuất rượu
- Quá trình lên men rượu nho là một ví dụ điển hình về ứng dụng của cân bằng hóa học trong sản xuất thực phẩm.
- Phản ứng chính trong quá trình lên men là:
C6H12O6 ⇌ 2C2H5OH + 2CO2
- Phản ứng này thuận nghịch và tỏa nhiệt.
- Men rượu (Saccharomyces cerevisiae) đóng vai trò là chất xúc tác để tăng tốc độ phản ứng và chuyển dịch cân bằng theo chiều thuận tạo ra rượu etylic.
Nguyên tắc hoạt động:
- Các ứng dụng của cân bằng hóa học đều dựa trên nguyên tắc điều chỉnh các điều kiện (nhiệt độ, áp suất, nồng độ,…) để chuyển dịch cân bằng theo chiều mong muốn.
- Hằng số cân bằng (K) là yếu tố quan trọng để xác định vị trí của cân bằng và hướng chuyển dịch của phản ứng.
- Việc sử dụng chất xúc tác có thể tăng tốc độ phản ứng và làm thay đổi vị trí của cân bằng.
Cách cân bằng phương trình hóa học
Cân bằng hóa học là trạng thái động của một phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Để mô tả trạng thái này, ta cần viết phương trình hóa học biểu diễn phản ứng và cân bằng phương trình đó.
Dưới đây là các bước hướng dẫn chi tiết cách cân bằng phương trình hóa học:
- Viết phương trình hóa học chưa cân bằng:
- Viết công thức hóa học của các chất tham gia phản ứng và sản phẩm trước và sau phản ứng.
- Sử dụng hệ số để biểu thị số lượng nguyên tử của mỗi nguyên tố trong từng chất.
Ví dụ: Phản ứng giữa axit clohidric (HCl) và natri hiđroxit (NaOH) tạo thành natri clorua (NaCl) và nước (H2O):
HCl + NaOH → NaCl + H2O
- Xác định nguyên tố cần cân bằng:
- So sánh số nguyên tử của mỗi nguyên tố ở vế trái và vế phải của phương trình.
- Nguyên tố nào có số nguyên tử khác nhau ở hai vế cần được cân bằng.
Ví dụ: Trong phương trình trên, số nguyên tử H, Cl, Na và O ở hai vế khác nhau.
- Cân bằng theo từng nguyên tố:
- Chọn một nguyên tố có số nguyên tử dễ cân bằng nhất (thường là nguyên tố có số nguyên tử lớn nhất hoặc xuất hiện nhiều nhất).
- Sử dụng hệ số để nhân hoặc chia các chất sao cho số nguyên tử của nguyên tố cần cân bằng bằng nhau ở hai vế.
- Lặp lại bước này cho đến khi tất cả các nguyên tố đều được cân bằng.
Ví dụ:
- Cân bằng nguyên tố H:
- Vế trái có 1H, vế phải có 1H, do đó không cần điều chỉnh.
- Cân bằng nguyên tố Cl:
- Vế trái có 1Cl, vế phải có 1Cl, do đó không cần điều chỉnh.
- Cân bằng nguyên tố Na:
- Vế trái có 1Na, vế phải có 1Na, do đó không cần điều chỉnh.
- Cân bằng nguyên tố O:
- Vế trái có 1O, vế phải có 1O, do đó không cần điều chỉnh.
Phương trình hóa học đã được cân bằng:
HCl + NaOH → NaCl + H2O
- Kiểm tra lại:
- Sau khi cân bằng, cần kiểm tra lại xem số nguyên tử của mỗi nguyên tố ở hai vế đã bằng nhau hay chưa.
- Nếu chưa, cần điều chỉnh hệ số cho đến khi tất cả các nguyên tố đều được cân bằng.
Lưu ý:
- Khi cân bằng phương trình hóa học, không được thay đổi công thức hóa học của các chất.
- Chỉ có thể điều chỉnh hệ số trước các chất để cân bằng phương trình.
- Có thể sử dụng phương pháp chẵn lẻ để cân bằng nhanh một số phương trình hóa học đơn giản.
Ví dụ về phương pháp chẵn lẻ:
Cân bằng phương trình: Fe + HCl → FeCl2 + H2
- Xác định nguyên tố cần cân bằng: Cl (vế trái có 1Cl, vế phải có 2Cl).
- Áp dụng phương pháp chẵn lẻ:
- Vế trái có 1Cl (lẻ), nhân với hệ số 2 để thành chẵn.
- Vế phải có 2Cl (chẵn), nhân với hệ số 1 để giữ nguyên.
- Phương trình hóa học đã được cân bằng:
2Fe + 6HCl → 2FeCl2 + 3H2
Hiểu biết về cân bằng hóa học không chỉ cải thiện khả năng chúng ta dự đoán và điều khiển các phản ứng hóa học mà còn có ảnh hưởng lớn đến các quyết định trong sản xuất công nghiệp. Nghiên cứu và ứng dụng các nguyên tắc cân bằng sẽ tiếp tục mở rộng biên giới của khoa học và công nghệ.









