Nguyên tố Kẽm đóng vai trò thiết yếu trong nhiều lĩnh vực từ y tế đến công nghiệp. Bài viết này yeuhoahoc.edu.vn sẽ khám phá lịch sử, tính chất và ứng dụng phong phú của nguyên tố quan trọng này.
Giới thiệu về nguyên tố Kẽm
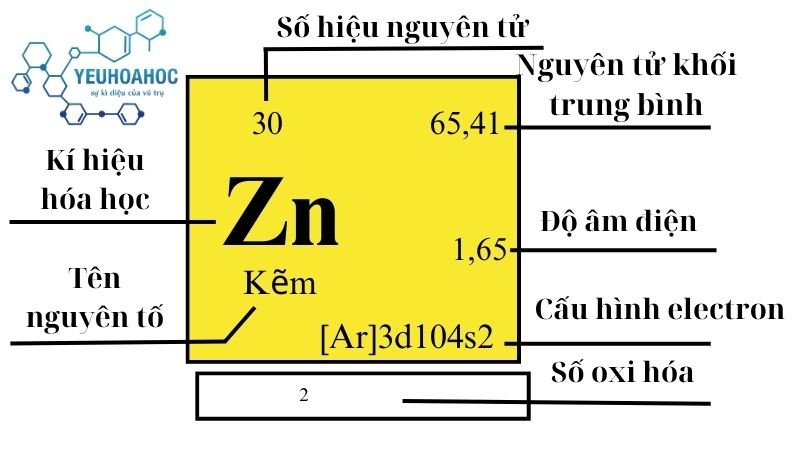
Định nghĩa
Kẽm, hay Zinc trong tiếng Anh, là nguyên tố hóa học với ký hiệu Zn và số nguyên tử 30. Đây là một kim loại màu trắng bạc, được biết đến với khả năng chống ăn mòn và dễ dàng hợp kim hóa với các kim loại khác.
Lịch sử hình thành nguyên tố Kẽm:
- Kẽm đã được sử dụng từ thời cổ đại, nhưng mãi đến thế kỷ 18 mới được xác định là một nguyên tố riêng biệt.
- Nhà hóa học người Đức Andreas Marggraf được công nhận là người đầu tiên tách biệt Kẽm từ calamine (một loại khoáng vật của Kẽm) vào năm 1746.
- Sự phát hiện này đã mở đường cho việc sản xuất Kẽm trong quy mô công nghiệp và tăng cường ứng dụng của nó trong cuộc sống hàng ngày.
- Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- Thế kỷ 10: Người Ấn Độ đã sử dụng kẽm để làm hợp kim đồng thau.
- Thế kỷ 13: Người Trung Quốc sử dụng kẽm để mạ kim loại.
- Thế kỷ 16: Paracelsus, một nhà giả kim thuật người Thụy Sĩ, đã mô tả kẽm như một nguyên tố riêng biệt.
- Năm 1746: Andreas Marggraf, một nhà hóa học người Đức, đã xác định kẽm là một nguyên tố.
Tầm quan trọng của nguyên tố Kẽm trong đời sống
- Kẽm là một dạng vi chất dinh dưỡng không thể thiếu cho sức khỏe của cơ thể con người.
- Kẽm tham gia vào nhiều chức năng quan trọng trong cơ thể, bao gồm:
- Tăng trưởng và phát triển
- Hệ miễn dịch
- Chức năng thần kinh
- Sức khỏe sinh sản
- Chữa lành vết thương
Nguyên tố Kẽm trong bảng tuần hoàn các nguyên tố hóa học
Trong bảng tuần hoàn, Kẽm nằm ở nhóm 12 và là một phần của chu kỳ 4. Đặc tính hóa học của Kẽm, bao gồm trạng thái oxi hóa +2 ổn định.
- Kẽm nằm ở nhóm 12 (IIB) trong bảng tuần hoàn hóa học.
- Nhóm này còn được gọi là nhóm kim loại kẽm.
- Các nguyên tố khác trong nhóm 12 bao gồm:
- Cadmium (Cd)
- Thủy ngân (Hg)
- Copernicium (Cn)
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 12 | 4 | 65,38(2) | 7,134 | 692,88 | 1180 | 0,388 | 1,65 | 70 |
Tính chất của nguyên tố Kẽm (Zn)
Tính chất vật lý
- Kẽm là kim loại màu trắng xám, có ánh kim.
- Kẽm có độ cứng trung bình, dễ dát mỏng và kéo thành sợi.
- Kẽm có nhiệt độ nóng chảy thấp (419,5 °C) và nhiệt độ sôi cao (907 °C).
- Kẽm dẫn điện và dẫn nhiệt tốt.
Tính chất hóa học
Kẽm là kim loại có tính khử trung bình.
- Kẽm tác dụng với axit:
Zn + 2HCl → ZnCl2 + H2↑
Zn + H2SO4 → ZnSO4 + H2↑
Kẽm tác dụng với dung dịch muối của kim loại đứng sau nó trong dãy điện hóa:
Zn + CuSO4 → ZnSO4 + Cu↓
Zn + AgNO3 → Zn(NO3)2 + Ag↓
Kẽm tác dụng với oxi:
2Zn + O2 → 2ZnO
Kẽm tác dụng với axit nitric:
4Zn + 10HNO3 → 4Zn(NO3)2 + N2↑ + 5H2O
Phương trình ví dụ cho từng phản ứng
Kẽm tác dụng với axit hydrochloric:
Zn + 2HCl → ZnCl2 + H2↑
Kẽm tác dụng với dung dịch muối đồng sunfat:
Zn + CuSO4 → ZnSO4 + Cu↓
Kẽm tác dụng với oxi:
2Zn + O2 → 2ZnO
Kẽm tác dụng với axit nitric:
4Zn + 10HNO3 → 4Zn(NO3)2 + N2↑ + 5H2O
Lưu ý:
- Kẽm không tác dụng với nước.
- Kẽm bị khử trong dung dịch kiềm.
Tóm lại:
- Kẽm là kim loại có tính khử trung bình.
- Kẽm tác dụng với axit, dung dịch muối của kim loại đứng sau nó trong dãy điện hóa, oxi và axit nitric.
Ứng dụng của nguyên tố Kẽm (Zn)

Kẽm là một nguyên tố hóa học quan trọng với nhiều ứng dụng trong đời sống. Dưới đây là một số ứng dụng phổ biến nhất của kẽm:
Mạ kim loại
- Kẽm được sử dụng để mạ kim loại khác (như sắt, thép) để bảo vệ chúng khỏi bị ăn mòn.
- Lớp mạ kẽm có khả năng chống gỉ tốt, bền bỉ và có thể chịu được nhiều điều kiện môi trường khắc nghiệt.
Sản xuất hợp kim
- Kẽm được sử dụng để sản xuất nhiều loại hợp kim quan trọng, bao gồm:
- Đồng thau (hợp kim của đồng và kẽm)
- Niken bạc (hợp kim của niken, đồng và kẽm)
- Hợp kim hàn
Pin
- Kẽm được sử dụng làm điện cực âm trong pin kẽm-carbon, một loại pin phổ biến được sử dụng trong nhiều thiết bị điện tử.
Hóa chất
- Kẽm được sử dụng trong sản xuất nhiều loại hóa chất, bao gồm:
- Oxit kẽm (ZnO): được sử dụng trong sản xuất cao su, sơn, kem chống nắng
- Clorua kẽm (ZnCl2): được sử dụng trong sản xuất chất khử mùi, chất tẩy rửa
- Sulfat kẽm (ZnSO4): được sử dụng trong sản xuất phân bón, mạ điện
Phân bón và thúc đẩy tăng trưởng thực vật
- Sulfat Kẽm là một thành phần trong nhiều loại phân bón, giúp thúc đẩy tăng trưởng thực vật và được sử dụng trong nông nghiệp để tăng cường năng suất cây trồng
Chất diệt khuẩn
- Kẽm được sử dụng trong việc sản xuất chất diệt khuẩn và các sản phẩm chăm sóc cá nhân, bao gồm kem đánh răng và lọ mắt do khả năng ức chế vi khuẩn và virus
Y học
- Kẽm là một vi chất dinh dưỡng thiết yếu cho cơ thể con người.
- Kẽm tham gia vào nhiều chức năng quan trọng trong cơ thể, bao gồm:
- Tăng trưởng và phát triển
- Hệ miễn dịch
- Chức năng thần kinh
- Sức khỏe sinh sản
- Chữa lành vết thương
- Kẽm được sử dụng để điều trị một số bệnh lý, bao gồm:
- Viêm da
- T tiêu chảy
- Nhiễm trùng
- Thiếu kẽm
Ngoài ra, kẽm còn được sử dụng trong nhiều lĩnh vực khác như:
- Nông nghiệp: Kẽm được sử dụng làm phân bón vi lượng để tăng năng suất cây trồng.
- Xây dựng: Kẽm được sử dụng để mạ các构件 kim loại trong xây dựng.
- Mỹ phẩm: Kẽm được sử dụng trong sản xuất một số loại kem chống nắng và kem dưỡng da.
Điều chế và sản xuất nguyên tố Kẽm
Điều chế
Điều chế trong phòng thí nghiệm:
- Phương pháp khử hóa học: Dùng kim loại hoạt động hơn khử Zn2+ trong dung dịch muối kẽm.
Ví dụ:
Fe + ZnSO4 → FeSO4 + Zn
- Phương pháp điện phân: Dòng điện được truyền qua dung dịch muối kẽm, Zn2+ sẽ bị khử thành kim loại kẽm.
Phương trình điều chế:
Zn2+ + 2e- → Zn
Điều chế trong công nghiệp:
- Phương pháp tuyển quặng: Quặng kẽm được khai thác và nghiền nhỏ, sau đó được tuyển chọn để thu được kẽm tinh.
- Phương pháp nung luyện: Kẽm tinh được nung nóng trong lò luyện để tạo ra kẽm thô.
- Phương pháp tinh luyện: Kẽm thô được tinh chế bằng phương pháp điện phân hoặc phương pháp thủy luyện để thu được kẽm tinh khiết.
Sản xuất
- Sản xuất kẽm nguyên chất:
- Dùng phương pháp điện phân dung dịch ZnSO4.
- Dùng phương pháp thủy luyện để khử Zn2+ trong dung dịch muối kẽm.
- Sản xuất hợp kim kẽm:
- Pha trộn kẽm nguyên chất với các kim loại khác để tạo thành hợp kim kẽm.
Lưu ý:
- Quá trình sản xuất kẽm có thể gây ô nhiễm môi trường.
- Cần có các biện pháp để bảo vệ môi trường trong quá trình sản xuất kẽm.
Phương trình điều chế kẽm trong công nghiệp:
- Phương pháp nung luyện:
2ZnS + 3O2 → 2ZnO + 2SO2
ZnO + C → Zn + CO
Nguyên tố Kẽm (Zn) tham gia vào nhiều loại phản ứng hóa học khác nhau, từ phản ứng oxi hóa-khử đến phản ứng với axit. Dưới đây là một số ví dụ cụ thể về phản ứng của Kẽm:
Phản ứng của nguyên tố Kẽm
Phản ứng với Oxi
Khi Kẽm tác dụng với oxi, nó tạo thành ôxit kẽm (ZnO), một hợp chất trắng bền với nhiệt độ:
2Zn+O2→2ZnO
Phản ứng với Axit
Kẽm phản ứng với axit clohiđric (HCl) tạo ra muối kẽm clorua (ZnCl₂) và giải phóng khí hydro (H₂):
Zn+2HCl→ZnCl2+H2↑
Phản ứng với Bazơ
Kẽm cũng có thể phản ứng với bazơ mạnh như natri hydroxide (NaOH), tạo thành kẽmát của natri (Na₂[Zn(OH)₄]), một phức chất trong dung dịch:
Zn+2NaOH+2H2O→Na2[Zn(OH)4]
Phản ứng với các Ion kim loại khác
Trong phản ứng oxi hóa-khử, Kẽm có thể khử các ion kim loại khác từ dung dịch của chúng. Ví dụ, Kẽm có thể khử ion đồng (II) thành đồng kim loại:
Zn+Cu2+→Zn2++Cu
Phản ứng trong Pin Galvanic
Kẽm thường được sử dụng làm điện cực âm trong pin galvanic. Khi kết hợp với điện cực dương như đồng, phản ứng giữa Kẽm và ion trong dung dịch điện phân (như dung dịch sulfate) tạo ra dòng điện:
Zn−2e−→Zn2+ (tại điện cực âm)
Cu2++2e−→Cu (tại điện cực dương)
Tồn tại và khai thác nguyên tố Kẽm
Nguyên tố Kẽm (Zn) tồn tại chủ yếu dưới dạng khoáng vật trong vỏ Trái Đất và được khai thác từ các mỏ kẽm qua một quá trình tinh chế phức tạp. Dưới đây là thông tin chi tiết về cách tồn tại và khai thác nguyên tố Kẽm.
Tồn tại của Kẽm
Kẽm không tồn tại ở dạng nguyên tố tự do trong tự nhiên do tính chất hoạt động của nó. Thay vào đó, Kẽm thường được tìm thấy dưới dạng các khoáng vật, trong đó phổ biến nhất là:
- Sphalerite (ZnS): Đây là nguồn quặng chính của Kẽm, còn được gọi là zinc blende hoặc black-jack, với hàm lượng Zn cao nhất.
- Smithsonite (ZnCO₃): Còn được biết đến dưới tên calamine, là một nguồn quặng quan trọng khác của Kẽm.
- Hemimorphite (Zn₄Si₂O₇(OH)₂·H₂O): Một khoáng vật khác chứa Kẽm được khai thác cho mục đích sản xuất.
Khai thác Kẽm
Quá trình khai thác Kẽm thường bắt đầu với việc khai thác quặng kẽm từ các mỏ lộ thiên hoặc mỏ dưới lòng đất. Sau đó, quặng được xử lý để trích xuất Kẽm bằng các phương pháp như:
- Tuyển Nổi: Quá trình này được sử dụng để tách kẽm từ các khoáng vật không chứa kẽm, bằng cách sử dụng các chất hóa học để làm cho các hạt chứa kẽm có khả năng bám vào bọt khí và tách ra khỏi hỗn hợp.
- Lixivi Hóa: Quá trình này bao gồm việc sử dụng dung dịch axit để hòa tan kẽm từ quặng, sau đó kẽm được trích xuất từ dung dịch này.
Tinh chế Kẽm
Sau khi khai thác và tuyển quặng, kẽm được tinh chế qua các bước như:
- Luyện Kim: Kẽm thô được sản xuất thông qua quá trình luyện kim, thường là bằng cách nung quặng kẽm trong không khí để chuyển đổi nó thành oxit kẽm, sau đó giảm oxit này bằng than cốc để sản xuất kẽm kim loại.
- Điện Phân: Đối với việc sản xuất kẽm tinh khiết cao, oxit kẽm có thể được hòa tan trong axit sulfuric và sau đó được tinh chế bằng quá trình điện phân.
Vấn đề an toàn khi sử dụng nguyên tố Kẽm
Kẽm là một kim loại thiết yếu cho cơ thể con người. Nó có vai trò quan trọng trong nhiều chức năng của cơ thể, bao gồm:
- Hệ miễn dịch
- Chức năng sinh sản
- Tăng trưởng và phát triển
- Chữa lành vết thương
Tuy nhiên, tiếp xúc với lượng kẽm lớn có thể gây hại cho sức khỏe. Một số triệu chứng của ngộ độc kẽm bao gồm:
- Buồn nôn
- Nôn
- Tiêu chảy
- Đau bụng
- Chuột rút
- Nhức đầu
- Sốt
- Lơ mơ
Dấu hiệu ngộ độc kẽm cấp tính có thể dẫn đến tử vong.
Ngoài ra, kẽm cũng có thể gây ra các tác dụng phụ khác như:
- Kích ứng da
- Kích ứng mắt
- Viêm phế quản
- Thiếu hụt đồng
Biện pháp phòng ngừa:
- Để đảm bảo an toàn khi sử dụng kẽm, cần thực hiện các biện pháp phòng ngừa sau:
- Hạn chế tiếp xúc với kẽm, đặc biệt là với lượng kẽm lớn.
- Sử dụng các biện pháp bảo hộ cá nhân khi làm việc với kẽm, chẳng hạn như găng tay, khẩu trang và kính bảo hộ.
- Làm việc trong khu vực thông gió tốt.
- Tuân thủ các quy định về an toàn khi sử dụng kẽm.
- Đọc kỹ hướng dẫn sử dụng trước khi dùng các sản phẩm có chứa kẽm.
- Tham khảo ý kiến bác sĩ trước khi sử dụng các sản phẩm bổ sung kẽm.
Chất lượng và phương thức cung cấp nguyên tố Kẽm
Chất lượng Kẽm
- Kẽm có thể được tìm thấy trong nhiều dạng khác nhau, bao gồm:
- Kẽm nguyên chất
- Hợp kim kẽm
- Hợp chất kẽm
- Chất lượng của kẽm được đánh giá dựa trên độ tinh khiết và hàm lượng tạp chất.
- Kẽm nguyên chất có độ tinh khiết cao nhất, thường được sử dụng trong các ứng dụng điện tử và y tế.
- Hợp kim kẽm được sử dụng trong nhiều ứng dụng khác nhau, bao gồm mạ kim loại, sản xuất pin và hợp kim.
- Hợp chất kẽm được sử dụng trong nhiều ứng dụng khác nhau, bao gồm sản xuất hóa chất, phân bón và y tế.
Phương thức cung cấp Kẽm
- Kẽm có thể được cung cấp dưới nhiều dạng khác nhau, bao gồm:
- Kẽm thỏi
- Kẽm tấm
- Kẽm bột
- Dung dịch kẽm
- Hợp chất kẽm
- Phương thức cung cấp kẽm phù hợp sẽ phụ thuộc vào ứng dụng cụ thể.
- Kẽm thỏi và kẽm tấm thường được sử dụng trong mạ kim loại và sản xuất hợp kim.
- Kẽm bột được sử dụng trong sản xuất pin và một số loại hóa chất.
- Dung dịch kẽm được sử dụng trong mạ điện và một số ứng dụng y tế.
- Hợp chất kẽm được sử dụng trong nhiều ứng dụng khác nhau, bao gồm sản xuất phân bón, hóa chất và y tế.
Lưu ý:
- Khi lựa chọn kẽm, cần phải xem xét chất lượng và phương thức cung cấp phù hợp với ứng dụng cụ thể.
- Cần phải tuân thủ các quy định về an toàn khi sử dụng kẽm.
Tóm lại:
- Kẽm có thể được tìm thấy trong nhiều dạng khác nhau với chất lượng và phương thức cung cấp khác nhau.
- Lựa chọn kẽm phù hợp sẽ phụ thuộc vào ứng dụng cụ thể.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Kẽm mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Kẽm. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









