Cobalt, với ký hiệu hóa học là Co, là một trong những nguyên tố quan trọng với nhiều ứng dụng đa dạng trong công nghiệp và khoa học. Với màu xanh lam đặc trưng và tính chất từ nam châm đến chống ăn mòn, cobalt đã trở thành một phần không thể thiếu trong sản xuất pin lithium-ion, hợp kim siêu cứng và các thiết bị y tế. Hãy cùng yeuhoahoc.edu.vn khám phá sâu hơn về tính chất và ứng dụng của nguyên tố Cobalt trong bài viết dưới đây.
Giới thiệu về nguyên tố Cobalt
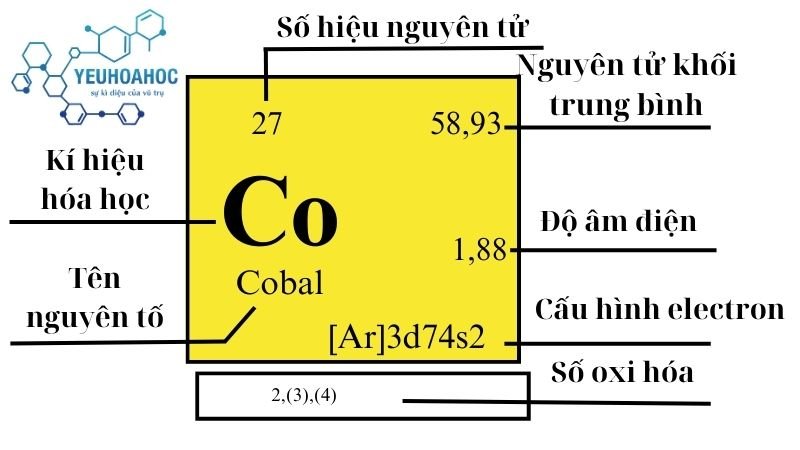
Định nghĩa
- Cobalt (Co) là một nguyên tố hóa học trong bảng tuần hoàn, có số nguyên tử 27 và ký hiệu Co.
- Là kim loại màu trắng bạc, cứng, giòn, có tính từ.
- Cobalt nằm trong nhóm 9 (nhóm VIIIB) và chu kỳ 4 của bảng tuần hoàn.
Lịch sử hình thành nguyên tố Cobalt
- Thời cổ đại:
- Người ta đã sử dụng hợp chất cobalt để tạo ra màu xanh lam cho thủy tinh và đồ gốm từ thời cổ đại.
- Màu xanh coban được sử dụng trong các tác phẩm nghệ thuật từ thời Ai Cập cổ đại, Hy Lạp và La Mã.
- Thế kỷ 17:
- Năm 1735, nhà khoa học người Thụy Điển Georg Brandt phát hiện ra cobalt là một nguyên tố riêng biệt.
- Ông đã tách cobalt ra khỏi quặng asenit coban.
- Thế kỷ 19:
- Cobalt được sử dụng để sản xuất thép cobalt, một loại thép có độ bền cao và chống ăn mòn tốt.
- Cobalt còn được ứng dụng trong việc chế tạo các loại nam châm không bị mất từ tính theo thời gian.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1735: Georg Brandt phát hiện ra cobalt.
- 1780: Torbern Bergman đặt tên cho nguyên tố này là “cobalt”.
- 1804: Louis Nicolas Vauquelin xác định cobalt là một kim loại.
- 1904: William Henry Bragg và William Lawrence Bragg phát hiện ra cấu trúc tinh thể của cobalt.
- 1938: Glenn Seaborg và John Livingood phát hiện ra đồng vị phóng xạ Co-60.
Tầm quan trọng của nguyên tố Cobalt trong đời sống
- Cobalt là một nguyên tố thiết yếu cho cơ thể con người.
- Nó là thành phần của vitamin B12, giúp cơ thể tạo ra tế bào hồng cầu.
- Cobalt cũng được sử dụng trong nhiều sản phẩm công nghiệp, bao gồm:
- Hợp kim: thép cobalt, stellite
- Nam châm vĩnh cửu
- Pin
- Xúc tác
- Men gốm
- Sơn
- Dụng cụ y tế
Nguyên tố Cobalt trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn, Cobalt nằm ở nhóm 9 và là một phần của dãy chuyển tiếp. Nó tương đối dễ dàng kết hợp với các nguyên tố khác và tồn tại ở nhiều dạng hợp chất khác nhau, từ các hợp chất cơ bản như cobalt(II) chloride (CoCl₂) đến các phức chất phức tạp.
- Thuộc nhóm 9 (nhóm VIIIB) và chu kỳ 4.
- Có cấu hình electron: 1s2 2s2 2p6 3s2 3p6 3d7 4s2.
- Có khối lượng nguyên tử: 58,933195 u.
- Có độ âm điện: 1,88.
- Có bán kính nguyên tử: 1,25 Å.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 9 | 4 | 58,933195(5) | 8,86 | 1768 | 3200 | 0,421 | 1,88 | 25 |
Tính chất của nguyên tố Cobalt
Tính chất vật lý
- Là kim loại màu trắng bạc, cứng, giòn, có tính từ.
- Có khối lượng riêng cao (8,9 g/cm³).
- Có nhiệt độ nóng chảy cao (1495 °C).
- Có nhiệt độ sôi cao (2927 °C).
- Dẫn điện và dẫn nhiệt tốt.
- Có tính từ mạnh.
- Bị oxy hóa chậm trong không khí.
Tính chất hóa học

Tính chất hóa học của nguyên tố Cobalt
- Có hóa trị +2 và +3.
- Dễ tác dụng với axit.
- Tác dụng với dung dịch muối của kim loại đứng sau trong dãy điện hóa.
- Bị khử bởi khí CO, H2 khi nung nóng.
- Tạo thành hợp chất với nhiều nguyên tố khác.
Một số hợp chất quan trọng của Cobalt
- CoCl2: Muối cobalt(II) clorua, màu hồng, tan trong nước.
- CoSO4: Muối cobalt(II) sunfat, màu hồng, tan trong nước.
- Co(NO3)2: Muối cobalt(II) nitrat, màu hồng, tan trong nước.
- Co3O4: Oxit cobalt(II,III), màu đen, không tan trong nước.
- CoO: Oxit cobalt(II), màu xanh lục, không tan trong nước.
Ứng dụng của nguyên tố Cobalt
Cobalt là một nguyên tố kim loại có nhiều ứng dụng trong nhiều lĩnh vực khác nhau. Một số ứng dụng quan trọng nhất của cobalt bao gồm:
Hợp kim
- Cobalt được sử dụng để sản xuất thép cobalt, một loại thép có độ bền cao và chống ăn mòn tốt. Thép cobalt được sử dụng trong các ứng dụng như dụng cụ cắt, khuôn mẫu và máy móc.
Cobalt cũng được sử dụng để sản xuất hợp kim stellite, một loại hợp kim có khả năng chống mài mòn và ăn mòn cao. Stellite được sử dụng trong các ứng dụng như van, cánh quạt và máy móc khai thác.
Nam châm
- Cobalt là một thành phần quan trọng trong sản xuất nam châm vĩnh cửu. Nam châm vĩnh cửu được sử dụng trong nhiều ứng dụng khác nhau, bao gồm động cơ điện, máy móc và đồ chơi.
Pin
- Cobalt được sử dụng làm catôt trong pin lithium-ion. Pin lithium-ion được sử dụng trong nhiều thiết bị điện tử di động, bao gồm điện thoại di động, máy tính xách tay và xe điện.
Xúc tác
- Cobalt được sử dụng làm xúc tác trong nhiều phản ứng hóa học khác nhau. Ví dụ, cobalt được sử dụng để xúc tác quá trình hydro hóa dầu mỏ để sản xuất nhiên liệu và hóa chất.
Y tế
- Cobalt được sử dụng trong một số ứng dụng y tế, bao gồm điều trị ung thư và thiếu máu. Cobalt-60 là một đồng vị phóng xạ được sử dụng để điều trị ung thư.
Men gốm
- Cobalt được sử dụng để tạo màu xanh lam trong men gốm. Màu xanh coban được sử dụng trong nhiều loại đồ gốm, bao gồm đồ sứ và đồ trang trí.
Sơn
- Cobalt được sử dụng để tạo màu xanh lam và xanh lục trong sơn. Sơn cobalt được sử dụng trong nhiều ứng dụng khác nhau, bao gồm nhà cửa, ô tô và máy móc.
Ngoài ra, cobalt còn được sử dụng trong một số ứng dụng khác, bao gồm:
- Dụng cụ cắt
- khuôn mẫu
- Máy móc khai thác
- Van
- Cánh quạt
- Đồ chơi
- Thiết bị điện tử
Lưu ý:
- Cobalt là một nguyên tố độc hại nếu tiếp xúc với lượng lớn.
- Nên cẩn thận khi sử dụng cobalt và các hợp chất của nó.
Điều chế và sản xuất nguyên tố Cobalt
Điều chế
Điều chế trong phòng thí nghiệm:

Điều chế nguyên tố Cobalt trong phòng thí nghiệm
- Phương pháp khử hydro hóa:
- Dùng khí hydro khử cobalt(II) oxit:
CoO + H2 → Co + H2O
-
- Dùng khí hydro khử cobalt(II) cacbonat:
CoCO3 + H2 → Co + CO2 + H2O
- Phương pháp điện phân:
- Điện phân dung dịch muối cobalt(II):
Co2+ + 2e- → Co
Điều chế trong công nghiệp:
- Phương pháp thủy luyện:
- Quặng coban được nghiền nhỏ và nung nóng để loại bỏ tạp chất.
- Quặng sau đó được axit hóa để tạo ra dung dịch muối coban.
- Cobalt được thu hồi từ dung dịch bằng cách điện phân hoặc kết tủa.
- Phương pháp pyrometallurgy:
- Quặng coban được nung nóng với các chất khử như carbon hoặc sulfide để tạo ra kim loại coban.
- Kim loại coban sau đó được tinh chế bằng phương pháp điện phân hoặc thổi khí.
Sản xuất
- Cobalt được sản xuất chủ yếu từ quặng coban.
- Quặng coban được khai thác ở nhiều nơi trên thế giới, bao gồm Úc, Canada, Trung Quốc, Nga và Zambia.
- Quá trình sản xuất coban bao gồm các bước sau:
Khai thác quặng coban.
Nghiền nhỏ và nung nóng quặng coban.
Axit hóa quặng coban để tạo ra dung dịch muối coban.
Thu hồi coban từ dung dịch bằng cách điện phân hoặc kết tủa.
Tinh chế coban bằng phương pháp điện phân hoặc thổi khí.
Phản ứng của nguyên tố Cobalt
Phản ứng với axit
- Cobalt tác dụng với axit clohydric để tạo ra khí hydro và muối cobalt(II) clorua:
Co + 2HCl → CoCl2 + H2
- Cobalt tác dụng với axit nitric để tạo ra khí nitơ oxit và muối cobalt(II) nitrat:
3Co + 8HNO3 → 3Co(NO3)2 + 2NO + 4H2O
Phản ứng với oxy
- Cobalt tác dụng với oxy khi nung nóng để tạo ra oxit cobalt(II,III):
2Co + 3O2 → Co3O4
Phản ứng với dung dịch muối
- Cobalt tác dụng với dung dịch muối đồng(II) sunfat để tạo ra kim loại đồng và muối cobalt(II) sunfat:
Co + CuSO4 → CoSO4 + Cu
Phản ứng với halogen
- Cobalt tác dụng với khí clo khi nung nóng để tạo ra muối cobalt(II) clorua:
Co + Cl2 → CoCl2
Phản ứng với hợp chất hữu cơ
- Cobalt được sử dụng làm xúc tác trong một số phản ứng hóa học hữu cơ, chẳng hạn như hydro hóa và khử hydro hóa.
Ngoài ra, cobalt còn tham gia vào một số phản ứng khác, chẳng hạn như:
- Phản ứng với kiềm
- Phản ứng với axit sunfuric
- Phản ứng với amoniac
Tồn tại và khai thác nguyên tố Cobalt
Tồn tại
- Cobalt là một nguyên tố tương đối hiếm, chiếm khoảng 0,0029% vỏ Trái đất.
- Nó thường được tìm thấy trong các khoáng chất như cobaltit, erythrite và glaucodot.
- Cobalt cũng có thể được tìm thấy trong quặng niken, đồng và sắt.
Khai thác
- Cobalt được khai thác ở nhiều nơi trên thế giới, bao gồm Úc, Canada, Trung Quốc, Nga và Zambia.
- Quá trình khai thác coban bao gồm các bước sau:
- Khai thác quặng coban.
- Nghiền nhỏ và nghiền quặng coban.
- Làm giàu quặng coban bằng phương pháp tuyển nổi hoặc lixiviat.
- Chiết xuất coban từ quặng bằng phương pháp thủy luyện hoặc pyrometallurgy.
Lưu ý:
- Khai thác coban có thể gây ra tác động tiêu cực đến môi trường, bao gồm ô nhiễm nước và đất.
- Nên sử dụng coban một cách hiệu quả và tái chế khi có thể.
Vấn đề an toàn khi sử dụng nguyên tố Cobalt
Cobalt là một nguyên tố có thể gây hại cho sức khỏe con người nếu tiếp xúc với lượng lớn.
Dưới đây là một số vấn đề an toàn cần lưu ý khi sử dụng nguyên tố Cobalt:
Độc tính:
- Cobalt có thể gây ra các vấn đề về hô hấp, tiêu hóa và thần kinh.
- Tiếp xúc với cobalt lâu dài có thể dẫn đến ung thư phổi.
- Cobalt cũng có thể gây ra dị ứng da.
Nguy cơ cháy nổ:
- Bụi cobalt có thể bắt lửa và nổ.
- Nên cẩn thận khi sử dụng cobalt trong môi trường dễ cháy nổ.
Nguy cơ ô nhiễm môi trường:
- Khai thác và sử dụng cobalt có thể gây ra ô nhiễm môi trường, bao gồm ô nhiễm nước và đất.
Để đảm bảo an toàn khi sử dụng nguyên tố Cobalt, bạn nên:
- Hạn chế tiếp xúc với cobalt.
- Sử dụng các biện pháp bảo hộ cá nhân khi làm việc với cobalt, chẳng hạn như găng tay, khẩu trang và kính bảo hộ.
- Làm việc trong khu vực thông gió tốt.
- Tuân thủ các quy định về an toàn khi sử dụng cobalt.
Chất lượng và phương thức cung cấp nguyên tố Cobalt
Chất lượng
- Cobalt có thể được cung cấp ở nhiều dạng khác nhau, bao gồm bột, viên, thanh và lá.
- Chất lượng của cobalt được đánh giá dựa trên độ tinh khiết và hàm lượng tạp chất.
- Cobalt có độ tinh khiết cao (99,9% trở lên) được sử dụng trong các ứng dụng điện tử và y tế.
- Cobalt có độ tinh khiết thấp hơn (95-99%) được sử dụng trong các ứng dụng công nghiệp.
Phương thức cung cấp
- Cobalt được cung cấp bởi các nhà sản xuất và nhà cung cấp hóa chất.
- Cobalt có thể được mua trực tiếp từ các nhà sản xuất hoặc thông qua các nhà phân phối.
- Cobalt thường được bán theo đơn vị tấn hoặc kilôgam.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Cobalt mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Cobalt. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









