Nguyên tố hóa học Nihoni là một trong những thành viên hết sức đặc biệt và quý hiếm trong bảng tuần hoàn. Không chỉ bởi vì nó là một nguyên tố nhân tạo, mà còn vì câu chuyện hấp dẫn đằng sau quá trình khám phá và đặt tên của nó. Bài viết này, yeuhoahoc.edu.vn sẽ đưa bạn đi từ định nghĩa cơ bản của nguyên tố Nihoni đến lịch sử hình thành và vị trí của nó trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Nihoni
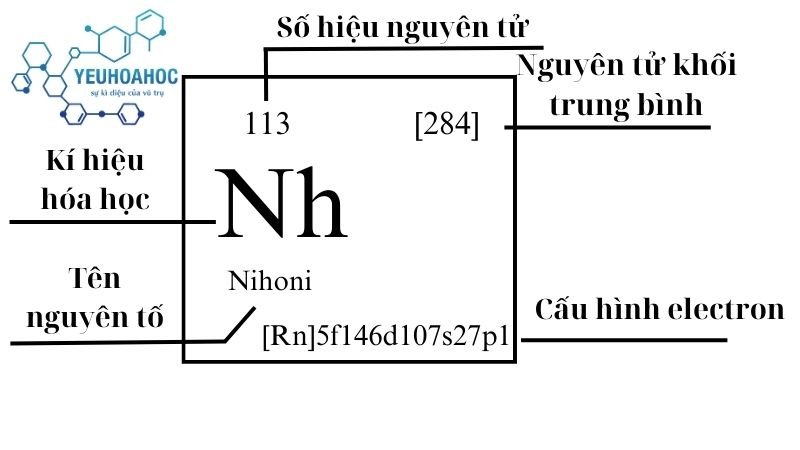
Nguyên tố Nihoni là gì?
Nihonium, với tên tiếng Anh là “Nihonium” và kí hiệu là “Nh”, là nguyên tố hóa học có số hiệu nguyên tử là 113. Đây là một nguyên tố siêu nặng, phóng xạ, và được biết đến như một nguyên tố nhân tạo vì nó không tồn tại tự nhiên mà được tổng hợp trong phòng thí nghiệm thông qua các phản ứng hạt nhân.
Lịch sử hình thành nguyên tố Nihoni
- 2003: Nhóm nghiên cứu tại Viện nghiên cứu hạt nhân Dubna (Nga) phát hiện ra nguyên tố 113 trong quá trình phân rã của nguyên tố 115 (ununpentium).
- 2004: Viện nghiên cứu RIKEN (Nhật Bản) tổng hợp thành công nguyên tố 113 bằng cách bắn phá bismuth-209 bằng ion kẽm-70.
- 2016: Liên minh Hóa học Quốc tế (IUPAC) chính thức công nhận nguyên tố 113 và đặt tên là Nihonium theo đề xuất của Nhật Bản.
Một số mốc thời gian quan trọng:
- 2003: Phát hiện ra nguyên tố 113 trong phân rã của ununpentium.
- 2004: Tổng hợp thành công nguyên tố 113 tại RIKEN.
- 2012: Xác nhận tính chất hóa học của nguyên tố 113.
- 2016: IUPAC công nhận nguyên tố 113 và đặt tên là Nihonium.
Nguyên tố Nihoni trong bảng tuần hoàn hóa học
- Nằm ở nhóm 13 (nhóm bo) của bảng tuần hoàn.
- Dự đoán có tính chất hóa học tương tự như các nguyên tố khác trong nhóm 13: bo, nhôm, gali, indium, thallium.
- Do tính chất phóng xạ, chỉ có thể nghiên cứu một số tính chất cơ bản của Nihonium.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 13 | 7 | [286] | (16) | (700) | (1400) | – | – | 0 |
Tính chất của nguyên tố Nihoni
Tính chất vật lý
- Do tính phóng xạ, chỉ có thể nghiên cứu một số tính chất vật lý cơ bản của Nihoni.
- Dự đoán có trạng thái rắn ở nhiệt độ phòng.
- Khối lượng nguyên tử: 284,118 u
- Mật độ dự đoán: 10 g/cm³
Tính chất hóa học
- Nằm ở nhóm 13 (nhóm bo) của bảng tuần hoàn, dự đoán có tính chất hóa học tương tự như các nguyên tố khác trong nhóm:
- Tạo thành hợp chất với oxy và hydro.
- Có thể tạo thành cation +3 trong dung dịch.
- Có thể khử thành kim loại.
- Do tính phóng xạ, chỉ thực hiện được một số thí nghiệm hóa học cơ bản để xác nhận tính chất hóa học của Nihonium.
- Một số nghiên cứu cho thấy Nihonium có thể có tính chất hóa học khác biệt so với các nguyên tố khác trong nhóm 13 do hiệu ứng tương đối tính.
Ví dụ về hợp chất của Nihoni
Nihonium(III) oxit (Nh2O3)
- Là một oxit kim loại, có màu nâu đỏ.
- Tan trong nước tạo thành axit Nihoniic (H3NhO3).
- Có tính khử mạnh.
Nihonium(III) chloride (NhCl3)
- Là một muối chloride, có màu vàng.
- Tan trong nước tạo thành dung dịch axit.
- Có tính khử mạnh.
Nihonium(III) fluoride (NhF3)
- Là một muối fluoride, có màu trắng.
- Tan trong nước tạo thành dung dịch axit.
- Có tính khử mạnh.
Ứng dụng của nguyên tố Nihoni
Hiện tại, nguyên tố Nihoni không có ứng dụng thực tế nào. Lý do là do:
- Tính phóng xạ: Nihoni là nguyên tố phóng xạ, có nghĩa là nó tự phân rã thành các nguyên tố khác theo thời gian. Điều này khiến nó không an toàn và không ổn định để sử dụng trong các ứng dụng thực tế.
- Khó tổng hợp: Việc tổng hợp Nihoni rất phức tạp và tốn kém. Chỉ có một số lượng nhỏ Nihoni được tạo ra trong các phòng thí nghiệm trên thế giới.
- Tính chất chưa được xác định đầy đủ: Do số lượng Nihoni được tạo ra rất ít, các nhà khoa học vẫn chưa thể xác định đầy đủ các tính chất của nó. Điều này khiến việc dự đoán ứng dụng tiềm năng của nó trở nên khó khăn.
Tuy nhiên, việc nghiên cứu Nihoni vẫn có ý nghĩa khoa học quan trọng:
- Giúp hiểu rõ hơn về cấu tạo của hạt nhân nguyên tử và sự hình thành các nguyên tố nặng.
- Góp phần vào việc phát triển các kỹ thuật tổng hợp nguyên tố mới.
- Mở ra khả năng khám phá các ứng dụng mới trong tương lai.
Một số hướng nghiên cứu tiềm năng về ứng dụng của Nihoni:
- Sử dụng Nihoni trong y học để điều trị ung thư hoặc các bệnh khác.
- Sử dụng Nihoni trong khoa học vật liệu để phát triển các vật liệu mới có tính năng vượt trội.
- Sử dụng Nihoni trong công nghiệp để phát triển các nguồn năng lượng mới.
Điều chế và sản xuất nguyên tố Nihoni
Điều chế
Điều chế trong phòng thí nghiệm:
- Phương pháp phổ biến nhất để điều chế Nihoni là phản ứng tổng hợp hạt nhân.
- Phản ứng này được thực hiện bằng cách bắn phá một mục tiêu bismuth-209 bằng ion kẽm-70.
- Khi va chạm, hai hạt nhân hợp nhất và tạo thành hạt nhân Nihoni-273.
- Hạt nhân Nihoni-273 sau đó phân rã thành các đồng vị khác nhau của Nihoni, bao gồm Nihoni-270, Nihoni-269, và Nihoni-268.
Phương trình phản ứng:
209Bi + 70Zn -> 273Nh* -> 270Nh + 3n
209Bi + 70Zn -> 273Nh* -> 269Nh + 4n
209Bi + 70Zn -> 273Nh* -> 268Nh + 5n
Điều chế trong công nghiệp:
Hiện tại, không có phương pháp nào để điều chế Nihoni trong công nghiệp. Lý do là do:
- Quá trình tổng hợp Nihoni rất phức tạp và tốn kém.
- Chỉ có một số lượng nhỏ Nihoni được tạo ra trong các phòng thí nghiệm trên thế giới.
Sản xuất
Hiện tại, không có sản xuất Nihoni trên quy mô lớn. Nihoni chỉ được tạo ra trong các phòng thí nghiệm nghiên cứu với số lượng rất nhỏ.
Phản ứng của nguyên tố Nihoni

Phản ứng tổng hợp
- Nihonium được tổng hợp lần đầu tiên vào năm 2003 tại Viện nghiên cứu hạt nhân Dubna (JINR) ở Nga bằng cách bắn phá bismuth-209 bằng kẽm-70:
209Bi + 70Zn → 279Nh* → 276Nh + 3n
- Năm 2004, nhóm nghiên cứu tại Trung tâm Khoa học Máy gia tốc RIKEN (Nhật Bản) cũng tổng hợp thành công Nihonium bằng cách sử dụng phản ứng tương tự.
Phản ứng phân rã
- Nihonium là nguyên tố phóng xạ, phân rã thành các đồng vị khác nhau của nguyên tố nhẹ hơn. Ví dụ:
276Nh → 272Rg + α (α là hạt nhân heli)
- Chu kỳ bán rã của các đồng vị Nihonium rất ngắn, đồng vị tồn tại lâu nhất là 286Nh có chu kỳ bán rã chỉ khoảng 20 giây.
Phản ứng hóa học
- Do số lượng Nihonium quá ít, việc nghiên cứu các phản ứng hóa học của nó gặp nhiều khó khăn. Tuy nhiên, các nhà khoa học đã thực hiện được một số thí nghiệm sơ bộ và cho thấy Nihonium có thể thể hiện các tính chất hóa học tương tự như các nguyên tố nhóm 13 (như nhôm, gali, indium) trong bảng tuần hoàn.
Ví dụ cụ thể:
- Nihonium(III) chloride (NhCl3) được tổng hợp bằng cách cho Nihonium tác dụng với khí clo:
Nh + 3Cl2 → NhCl3
- Nihonium(III) hydroxide (Nh(OH)3) được tổng hợp bằng cách cho Nihonium tác dụng với dung dịch NaOH:
Nh + 3NaOH → Nh(OH)3 + 3Na
Vấn đề an toàn của nguyên tố Nihonium
Bức xạ
- Nihonium là nguyên tố phóng xạ, phát ra tia alpha và tia beta. Tia alpha có thể ion hóa các nguyên tử trong cơ thể, gây tổn thương DNA và dẫn đến ung thư. Tia beta có thể gây bỏng da và tổn thương mắt.
Độc tính
- Nihonium là kim loại nặng, có thể tích tụ trong cơ thể và gây ngộ độc. Các triệu chứng ngộ độc Nihonium bao gồm buồn nôn, nôn, tiêu chảy, đau bụng, rụng tóc và suy giảm chức năng thận.
Nguy cơ lây nhiễm
- Nihonium có thể bị lây nhiễm qua đường hô hấp hoặc tiêu hóa. Việc tiếp xúc với Nihonium có thể dẫn đến nhiễm trùng, đặc biệt nguy hiểm cho những người có hệ miễn dịch yếu.
Để đảm bảo an toàn khi nghiên cứu và sử dụng Nihonium, cần thực hiện các biện pháp sau:
- Kiểm soát bức xạ: Sử dụng các biện pháp che chắn và thiết bị bảo hộ cá nhân để hạn chế tiếp xúc với bức xạ.
- Giảm thiểu nguy cơ ô nhiễm: Sử dụng các quy trình và thiết bị phù hợp để ngăn chặn sự lây lan của Nihonium trong môi trường.
- Theo dõi sức khỏe: Thường xuyên kiểm tra sức khỏe của những người tiếp xúc với Nihonium để phát hiện sớm các dấu hiệu ngộ độc hoặc nhiễm bệnh.
Kết thúc bài viết, chúng ta đã cùng nhau khám phá những thông tin thú vị và quan trọng về các nguyên tố Nihoni, mở ra cánh cửa kiến thức rộng lớn trong lĩnh vực hóa học. Tại yeuhoahoc.edu.vn, chúng tôi luôn cam kết cung cấp nội dung chất lượng cao, cập nhật và dễ hiểu, giúp bạn dễ dàng tiếp cận và yêu thích môn học này hơn. Đừng quên theo dõi chúng tôi để cập nhật những thông tin mới nhất và sâu sắc nhất về hóa học. Hãy cùng chúng tôi tiếp tục hành trình khám phá thế giới hóa học đầy màu sắc và bí ẩn!









