Hợp chất hóa học là nền tảng của cuộc sống và nhiều ứng dụng công nghệ. Bài viết dưới đây yeuhoahoc.edu.vn sẽ đưa bạn đến gần hơn với thế giới của hợp chất hóa học, từ khái niệm cơ bản, đặc điểm cấu tạo, đến những ví dụ điển hình.
Hợp chất là gì?

Hợp chất hóa học là chất được tạo thành từ hai hoặc nhiều nguyên tố hóa học khác nhau, liên kết với nhau qua liên kết hóa học. Mỗi hợp chất có tính chất đặc trưng không giống với tính chất của những nguyên tố tạo nên nó.
Hợp chất có thể bị phân hủy thành các nguyên tố hoặc hợp chất đơn giản hơn thông qua các phản ứng hóa học.
Đặc điểm cấu trúc của hợp chất
Cấu trúc của hợp chất phản ánh sự sắp xếp và liên kết giữa các nguyên tử của các nguyên tố khác nhau. Đặc điểm nổi bật của cấu trúc hợp chất bao gồm:
Gồm hai hay nhiều nguyên tố hóa học khác loại: Hợp chất được tạo thành từ hai hay nhiều nguyên tố hóa học khác loại. Ví dụ, nước (H2O) được tạo thành từ hai nguyên tố hóa học là hydro (H) và oxy (O).
Liên Kết Hóa Học: Các nguyên tử trong hợp chất liên kết với nhau qua liên kết ion (trao đổi electron) hoặc liên kết cộng hóa trị (chia sẻ electron).
Tỉ Lệ Nguyên Tố: Trong một hợp chất, nguyên tố hóa học tồn tại theo một tỉ lệ xác định và cố định, thể hiện qua công thức hóa học.
Cấu Trúc Phân Tử và Mạng Lưới Tinh Thể: Hợp chất có thể tồn tại dưới dạng phân tử riêng lẻ hoặc mạng lưới tinh thể, tùy thuộc vào loại liên kết và điều kiện vật lý.
Phân loại hợp chất
Hợp chất được chia thành hai loại chính là hợp chất cộng hóa trị và hợp chất ion.
Hợp chất cộng hóa trị
- Là những hợp chất mà các nguyên tố trong hợp chất liên kết với nhau bằng liên kết cộng hóa trị: Liên kết cộng hóa trị là liên kết giữa hai nguyên tử bằng cách chia sẻ electron.
- Có thể là hợp chất phân tử hoặc hợp chất mạng tinh thể: Hợp chất cộng hóa trị có thể là hợp chất phân tử, trong đó các phân tử hợp chất liên kết với nhau bằng lực liên kết yếu, hoặc là hợp chất mạng tinh thể, trong đó các phân tử hợp chất liên kết với nhau rất chặt chẽ tạo thành một mạng tinh thể.
- Có những tính chất hóa học và vật lý đặc trưng cho từng loại hợp chất cộng hóa trị: Ví dụ, hợp chất cộng hóa trị phân tử thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp, tan trong dung môi hữu cơ,…
Hợp chất ion
- Là những hợp chất mà các nguyên tố trong hợp chất liên kết với nhau bằng liên kết ion: Liên kết ion là liên kết giữa một nguyên tử mang điện dương và một nguyên tử mang điện âm.
- Có dạng mạng tinh thể: Hợp chất ion luôn có dạng mạng tinh thể.
- Có những tính chất hóa học và vật lý đặc trưng cho từng loại hợp chất ion: Ví dụ, hợp chất ion thường có nhiệt độ nóng chảy và nhiệt độ sôi cao, không tan trong dung môi hữu cơ,…
Một số ví dụ về hợp chất
Hợp chất cộng hóa trị
Nước (H₂O): Hợp chất quen thuộc nhất, gồm hai nguyên tử hydro và một nguyên tử oxy, là nền tảng cho sự sống trên Trái Đất.
Axit Sulfuric (H₂SO₄): Một hợp chất hóa học mạnh, được sử dụng rộng rãi trong công nghiệp, bao gồm sản xuất phân bón, xử lý dầu mỏ và hóa chất.
Hợp chất ion
- Natri Clorua (NaCl): Còn được biết đến là muối ăn, là hợp chất được tạo thành từ nguyên tố natri và clo, tồn tại dưới dạng mạng lưới tinh thể.
- Carbon Dioxide (CO₂): Một hợp chất khí tạo thành từ một nguyên tử cacbon và hai nguyên tử oxy, đóng vai trò quan trọng trong quá trình quang hợp của thực vật.
Hợp chất Hữu cơ
Hợp chất hữu cơ là gì?
Nguyên tử cacbon có khả năng tạo thành khoảng 10 triệu hợp chất khác nhau khi kết hợp với nguyên tử của các nguyên tố khác. Những hợp chất này đều thuộc vào loại hợp chất hữu cơ, trừ một số ít ngoại lệ như các oxit của cacbon, các muối cacbonat và cacbua kim loại.
Những điểm chung của các hợp chất hữu cơ
Các điểm chung của các hợp chất hữu cơ là những đặc trưng chung mà chúng có trong lĩnh vực hóa học hữu cơ.
- Nguyên Tố Cacbon (C): Tất cả các hợp chất hữu cơ chứa ít nhất một nguyên tử carbon. Carbon là nguyên tử cơ bản và quan trọng nhất trong hóa học hữu cơ.
- Nguyên Tố Hydrogen (H): Hydrogen thường kết hợp với carbon trong hợp chất hữu cơ để tạo thành liên kết carbon-hydrogen (C-H). Liên kết này là một đặc điểm quan trọng của hợp chất hữu cơ.
- Tính Đa Dạng: Hóa học hữu cơ đa dạng và phong phú, tạo ra hàng triệu hợp chất khác nhau với cấu trúc và tính chất đa dạng.
- Liên Kết C-C: Trong các hợp chất hữu cơ, nguyên tử cacbon thường liên kết với nhau qua liên kết C-C, tạo thành các chuỗi cacbon.
- Cấu Trúc Phân Tử Đa Dạng: Cấu trúc phân tử của hợp chất hữu cơ có thể đa dạng có thể là mạch thẳng, mạch nhánh hay mạch vòng.
- Phản Ứng Hóa Học: Hợp chất hữu cơ thường tham gia vào các phản ứng hóa học, bao gồm phản ứng oxi hóa, cắt đứt liên kết và tổng hợp các hợp chất mới.
Những đặc điểm này giúp xác định và phân loại các hợp chất hữu cơ, đồng thời làm nền tảng cho nghiên cứu và ứng dụng của hóa học hữu cơ trong nhiều lĩnh vực khác nhau.
Phân loại các hợp chất hữu cơ
Các hợp chất hữu cơ có thể được phân loại theo hai tiêu chí quan trọng sau đây:
Theo Nhóm Chức:
- Alkane (Hidrocarbon no): Các hợp chất này chỉ chứa liên kết C-C đơn. Ví dụ: methane (
), ethane ( ).
- Alkene (Hidrocarbon no chứa liên kết đôi C=C): Các hợp chất này chứa ít nhất một liên kết đôi carbon-carbon (C=C). Ví dụ: ethene (
), propene ().
- Alkyne (Hidrocacbon no chứa liên kết ba C≡C): Các hợp chất này chứa ít nhất một liên kết ba carbon-carbon (C≡C). Ví dụ: ethyne (CH≡CH), propyne (
). - Alcohol (Rượu): Chứa nhóm hydroxyl (-OH) gắn vào một nguyên tử cacbon. Ví dụ: ethanol (
),methanol ().
- Ketone (Keton): Có nhóm chức carbonyl (-C=O) nằm giữa hai nguyên tử cacbon. Ví dụ: acetone (
), propanone (
).
- Amine (Amin): Có ít nhất một nhóm amino (-
) gắn vào một nguyên tử cacbon. Ví dụ: methylamine (
), ethylamine (
).
- Acid Carboxylic (Axit Cacboxylic): Chứa nhóm axit cacboxylic (-COOH). Ví dụ: acetic acid (
), formic acid (HCOOH).
- Este (Este): Được tạo ra từ sự kết hợp giữa một acid cacboxylic và một cồn. Ví dụ: ethyl acetate (
), methyl formate (
).
- Heterocyclic Compounds (Hợp Chất Nguyên Tố Khác): Chứa ít nhất một nguyên tử khác với carbon trong vòng tròn, ví dụ như pyridine và furan.
- Aromatic Compounds (Hợp Chất Aromatic): Chứa một hoặc nhiều vòng benzen hoặc vòng có cấu trúc tương tự. Ví dụ: benzene (
), toluene (
).
Theo Mạch Cacbon:
- Mạch Đơn (Straight Chain): Các cacbon nối tiếp nhau trong một dãy thẳng. Ví dụ: butane (
).
- Mạch Phân Nhánh (Branched Chain): Các mạch phân nhánh của cacbon nằm rải rác. Ví dụ: isobutan

- Mạch Vòng (Cyclic Chain): Các cacbon nối thành một vòng đóng. Ví dụ: cyclohexane (
).
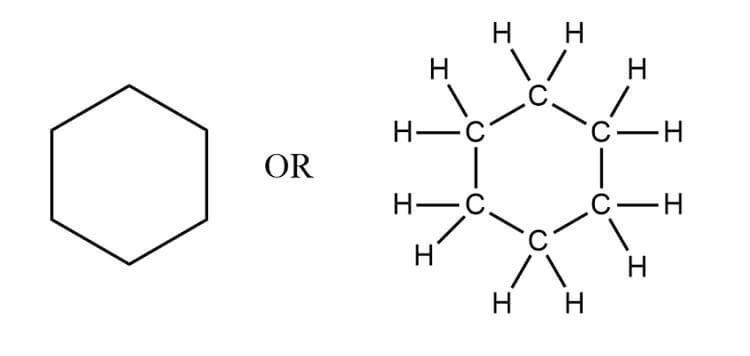
- Mạch Kết Hợp (Mixed Chain): Kết hợp giữa các mạch đơn, phân nhánh và vòng. Ví dụ: isopropyl alcohol (
).
Những tiêu chí này giúp xác định và phân loại các hợp chất hữu cơ theo cấu trúc và tính chất hóa học khác nhau.
Các phương pháp tách biệt và tinh chế hợp chất hữu cơ
Có nhiều phương pháp tách biệt và tinh chế hợp chất hữu cơ khác nhau, tùy thuộc vào tính chất cụ thể của hợp chất và mục tiêu của quá trình. Một số phương pháp phổ biến:
Quá trình kết tinh: Khi bạn có một hỗn hợp chứa hợp chất hữu cơ và dung môi, bạn có thể tạo điều kiện thích hợp để hợp chất kết tinh trong dung môi. Sau đó, bạn có thể tách biệt hợp chất kết tinh bằng cách lọc.
Sử dụng các tác nhân hóa học: Sử dụng phản ứng hóa học để biến đổi một trong các hợp chất thành dạng khác mà có thể tách biệt bằng phương pháp khác. Ví dụ, sử dụng phản ứng acid-base để tách axit và bazơ.
Sử dụng cột sắc ký: Phương pháp này sử dụng sự tương tác giữa các pha tĩnh và pha động trong cột sắc ký để tách biệt các hợp chất dựa trên tương tác của chúng với các pha này. Các loại cột sắc ký như cột sắc ký khí, cột sắc ký lỏng, và cột sắc ký sắc tố được sử dụng rộng rãi.
Sử dụng phương pháp distillation: Dựa vào sự khác biệt trong nhiệt độ sôi của các hợp chất, bạn có thể sử dụng distillation để tách biệt chúng. Có nhiều loại distillation như distillation chân không, distillation đơn, và distillation đa lớp.
Sử dụng phương pháp trích ly: Phương pháp này sử dụng sự tan trong các dung môi khác nhau để tách biệt các hợp chất. Sau đó, bạn có thể tách dung môi và thu hợp chất đã trích ly.
Sử dụng phương pháp sắc ký lỏng hiệu năng cao: Chromatography là một loạt các phương pháp tách biệt dựa trên tương tác giữa các hợp chất và các pha tĩnh hoặc động trong hệ thống sắc ký lỏng hiệu năng cao
Sử dụng phương pháp tinh chế cao cấp: Đối với các ứng dụng y tế và công nghiệp, có thể sử dụng các phương pháp tinh chế cao cấp như sử dụng sắc ký khí khối khối (GC-MS), tạo dạng chất lỏng siêu sạch (HPLC), và tinh chế tương tác khối lượng (SMB).
Sự lựa chọn phương pháp tách biệt và tinh chế phụ thuộc vào tính chất của hợp chất, mục tiêu của quá trình, và các điều kiện cụ thể.
Công thức cấu tạo và thuyết cấu tạo hoá học của hợp chất hữu cơ
Công thức cấu tạo (Structural Formula): Công thức cấu tạo là một biểu đồ hoặc biểu đồ tương tự sử dụng ký hiệu và đường nối để mô tả cụ thể cấu trúc của một hợp chất hóa học. Công thức cấu tạo cho biết loại nguyên tử trong hợp chất, cách chúng kết nối với nhau và cách chúng sắp xếp trong không gian.
Ví dụ:
Công thức cấu tạo của etan:
Thuyết cấu tạo hoá học (Chemical Structure Theory): Thuyết cấu tạo hoá học là một hệ thống các nguyên tắc và quy tắc mô tả cách mà các nguyên tử trong một hợp chất kết nối với nhau và sắp xếp trong không gian. Thuyết cấu tạo hoá học giải thích tại sao các hợp chất có cấu trúc và tính chất cụ thể.
Đồng đẳng (Isomer): Trong hóa học, đồng đẳng là các hợp chất có cùng công thức phân tử nhưng có cấu trúc khác nhau. Có hai loại chính của đồng đẳng:
- Đồng phân cấu trúc (Structural Isomer): Đây là các đồng đẳng có cùng công thức phân tử nhưng khác về cấu trúc, ví dụ như butan và isobutan.
- Đồng phân cấu hình (Stereoisomer): Đây là các đồng đẳng có cùng cấu trúc cơ bản nhưng khác về sự sắp xếp không gian của các nguyên tử, ví dụ như đồng phân cis-trans trong các hợp chất vòng.
Hiện tượng tautomer (Tautomerism): Hiện tượng tautomer là một trạng thái đồng đẳng đặc biệt giữa hai hình thức cấu tạo chất gốc chứa một nhóm chuyển đổi kép, thường là giữa dạng keto và dạng enol. Trong hiện tượng này, hai dạng cấu trúc có cùng thành phần nguyên tử nhưng khác nhau về cấu trúc cấu hình của các liên kết hóa học. Ví dụ phổ biến là hiện tượng tautomer giữa dạng keto và enol của ketone. Hiện tượng này có thể dẫn đến sự biến đổi tự nhiên của một chất từ một dạng thành dạng khác theo một cơ chế hóa học cụ thể.
Hợp chất vô cơ
Hợp chất vô cơ là gì

Hợp chất vô cơ là những hợp chất hóa học không chứa nguyên tử carbon (C) dưới dạng liên kết carbon-carbon (C-C) hoặc carbon-hydrogen (C-H). Thay vào đó, chúng thường chứa các nguyên tố hóa học khác nhau, ví dụ như kim loại, non-metal, hoặc các ion. Không giống như hợp chất hữu cơ, hợp chất vô cơ thường có tính chất vật lý và hóa học khác biệt.
Phân loại hợp chất vô cơ
Hợp chất vô cơ có thể được phân loại vào một số nhóm chính dựa trên tính chất và thành phần của chúng. Dưới đây là một số phân loại chính:
Oxit (Oxide): Hợp chất vô cơ chứa nguyên tử oxi kết hợp với một hoặc nhiều nguyên tố khác.
Ví dụ điển hình là Oxit sắt (
) và Oxit nhôm (
).
Acid (Axit): Acid là các hợp chất vô cơ có khả năng tạo ra ion hydrogen (H+) trong dung dịch nước. Chúng thường có công thức chứa nguyên tử hydrogen và một hoặc nhiều nguyên tố khác.
Ví dụ: Axit sulfuric (
) và Axit hydrochloric (HCl).
Bazo (Base): Bazơ là các hợp chất vô cơ có khả năng tạo ra ion hydroxide (OH-) trong dung dịch nước. Chúng thường có cấu trúc gồm các nguyên tử kim loại kết hợp với nhóm hydroxide.
Ví dụ: NaOH, KOH,
,…
Kim loại (Metal): Kim loại là nhóm nguyên tố hóa học có tính chất dẫn điện, nhiệt dẫn và có khả năng malleable. Hợp chất vô cơ có chứa nguyên tử kim loại được gọi là các hợp chất kim loại.
Ví dụ: Nhôm (Al), sắt (Fe), và đồng (Cu).
Muối (Salt): Muối là các hợp chất vô cơ được tạo thành từ sự kết hợp của các ion dương và ion âm. Ion dương thường là nguyên tử kim loại, trong khi ion âm thường là nguyên tử không kim loại hoặc các nhóm ion.
Ví dụ: Muối bàn (NaCl), Muối canxi (
).
Mối quan hệ giữa các hợp chất vô cơ
Mối quan hệ giữa các loại hợp chất vô cơ thường được thể hiện thông qua các phản ứng hóa học và sự tương tác trong các quá trình hóa học. Dưới đây là một số mối quan hệ quan trọng giữa các loại hợp chất vô cơ:
Muối và Acid/Bazo:
- Acid và bazo thường tạo ra muối thông qua quá trình trung hòa. Ví dụ:
- Muối có thể được tạo thành từ phản ứng giữa acid và kim loại, được gọi là phản ứng acid-kim loại.
Muối và Oxit:
- Muối có thể chứa ion kim loại dương và ion oxid âm. Ví dụ, Oxit sắt (
) là một loại oxit chứa kim loại sắt ( ) và ion oxit (
).
- Muối oxit thường tạo ra từ phản ứng giữa kim loại và oxi trong điều kiện nhiệt độ cao.
Acid và Bazo:
- Acid và bazo thường tạo ra nước và muối trong quá trình trung hòa. Ví dụ: HCl + NaOH → NaCl +
- Phản ứng trung hòa này xảy ra khi số lượng ion hydroxide (
) từ bazơ và ion hydrogen () từ acid bằng nhau.
Kim loại và Muối:
- Muối thường chứa ion kim loại dương và ion âm. Ví dụ, muối bàn (NaCl) có ion natri (
) và ion clorua ().
- Kim loại có thể được thu được từ muối thông qua phản ứng khử hoặc điện phân muối.
Oxit và Kim loại:
- Oxid thường tạo ra từ sự kết hợp của oxi và kim loại trong điều kiện nhiệt độ cao. Ví dụ, Oxit nhôm (
) chứa oxi và kim loại nhôm (Al).
- Các oxit kim loại có thể được sử dụng trong việc sản xuất kim loại nguyên tố thông qua phản ứng khử.
Ví dụ về hợp chất vô cơ
Muối (Sodium Chloride – NaCl): Muối bàn là một trong những hợp chất vô cơ phổ biến nhất và thường được sử dụng trong thực phẩm và để làm sạch nước. Nó là một muối được tạo thành từ sự kết hợp của ion natri (Na+) và ion clorua (Cl-).
Nước (Water –
): Nước là một hợp chất vô cơ đơn giản nhưng quan trọng. Nó được tạo thành từ hai nguyên tử hydrogen (H) và một nguyên tử oxi (O) liên kết với nhau. Nước là một dung môi quan trọng và cần thiết cho sự tồn tại của cuộc sống.
Dioxit cacbon (Carbon Dioxide –
): Đioxit cacbon là một khí không màu và không mùi được tạo thành từ một nguyên tử cacbon (C) và hai nguyên tử oxi (O).
Muối canxi (Calcium Carbonate –
): Muối canxi là một hợp chất vô cơ chứa ion canxi (
) và ion carbonate
(
). Nó thường được tìm thấy trong tự nhiên dưới dạng khoáng vật và được sử dụng trong công nghiệp sản xuất xi măng và trong dược phẩm.
Acid sulfuric (Sulfuric Acid –
): Acid sulfuric là một loại acid mạnh chứa nguyên tử hydrogen (H), nguyên tử lưu huỳnh (S) và nguyên tử oxi (O). Nó được sử dụng trong nhiều ngành công nghiệp, bao gồm sản xuất phân bón, thuốc nhuộm, và nhiều sản phẩm hóa học khác.
Bazo natri hydroxit (Sodium Hydroxide – NaOH): Bazo natri hydroxit là một hợp chất vô cơ chứa ion natri (Na+) và ion hydroxide (OH-). Nó là một bazơ mạnh và thường được sử dụng trong việc làm sạch và trong sản xuất xà phòng.
Muối magie sulfat (Magnesium Sulfate –
): Muối magie sulfat chứa ion magie (
) và ion sulfate (
). Nó thường được sử dụng trong y học và là một thành phần của một số loại muối bơi hồ.
Ứng dụng của hợp chất vô cơ
Hợp chất vô cơ có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau, từ công nghiệp đến y học và nông nghiệp. Dưới đây là một số ứng dụng quan trọng của hợp chất vô cơ:
Công nghiệp hóa chất:
- Hợp chất vô cơ được sử dụng rộng rãi trong sản xuất hóa chất khác, như acid sulfuric (
), axit nitric (), và axit clohidric (HCl).
- Kim loại và hợp chất kim loại được sử dụng để sản xuất hợp kim và các sản phẩm kim loại.
Nông nghiệp:
- Muối khoáng và phân bón chứa các hợp chất vô cơ như muối canxi (
) và muối kali (KCl) được sử dụng để cải thiện chất lượng đất và tăng sản xuất nông nghiệp. - Thuốc trừ sâu và phân bón có thể chứa các hợp chất vô cơ để kiểm soát côn trùng và cải thiện sự phát triển của cây trồng.
Công nghiệp xi măng và xây dựng:
- Muối canxi (
) được sử dụng làm thành phần chính của xi măng để xây dựng các công trình như nhà cửa, cầu đường và đập. - Muối silicat, như silica gel, được sử dụng làm chất tạo độ bền cho vật liệu xây dựng.
Y học và dược phẩm:
- Nhiều hợp chất vô cơ, chẳng hạn như muối magie sulfat (
) và muối kali clorua (KCl), được sử dụng trong y học để điều trị các tình trạng y tế như chuột rút và thiếu khoáng. - Thuốc kháng sinh và các dạng khác của dược phẩm chứa các hợp chất vô cơ để điều trị các bệnh và tình trạng y tế.
Công nghiệp thực phẩm:
- Hợp chất vô cơ như muối bàn (NaCl) được sử dụng làm chất điều chỉnh khẩu vị và bảo quản thực phẩm.
- Muối canxi (
) và kali sorbate (K sorbate) cũng được sử dụng để gia tăng tuổi thọ và bảo quản thực phẩm.
Năng lượng:
- Các hợp chất vô cơ như silicat và đioxit titan (
) được sử dụng trong ngành công nghiệp năng lượng để sản xuất tấm pin mặt trời và tấm nhiệt quang điện.
Môi trường và xử lý nước:
- Muối nhôm (Aluminum Sulfate –
) được sử dụng trong xử lý nước để kết tủa các hạt bẩn và tăng khả năng lọc nước.
Vật liệu và công nghệ:
- Hợp chất vô cơ, chẳng hạn như oxit titan (
), được sử dụng làm chất phủ bề mặt trong vật liệu xây dựng và sản phẩm công nghiệp như sơn và sơn chống thấm. - Các hợp chất vô cơ cũng có thể được sử dụng trong công nghệ vật liệu để cải thiện tính chất cơ học và điện tử của các vật liệu.
Hợp chất vô cơ đóng một vai trò quan trọng trong lĩnh vực hóa học và cuộc sống hàng ngày của chúng ta. Việc hiểu về cấu trúc, phân loại, và ứng dụng của họ giúp chúng ta áp dụng hiệu quả hóa học vào nhiều khía cạnh khác nhau của xã hội và công nghiệp.
Tính phần trăm nguyên tố trong hợp chất
Công thức tính phần trăm khối lượng của các nguyên tố trong một hợp chất được tính dựa trên khối lượng của mỗi nguyên tố trong hợp chất và tổng khối lượng của hợp chất đó. Công thức chung cho việc tính phần trăm khối lượng là:
Ví dụ: Hãy tính phần trăm khối lượng của các nguyên tố cacbon (C), hydrogen (H) và oxi (O) trong hợp chất ethyl alcohol (
).
- Khối lượng của nguyên tử cacbon (C) là khoảng 12.01 g/mol.
- Khối lượng của nguyên tử hydrogen (H) là khoảng 1.01 g/mol.
- Khối lượng của nguyên tử oxi (O) là khoảng 16.00 g/mol.
Bước 1: Tính tổng khối lượng của tất cả các nguyên tử trong hợp chất.
- Khối lượng tổng của
= (2 x 12.01 g/mol C) + (6 x 1.01 g/mol H) + (1 x 16.00 g/mol H) + (1 x 1.01 g/mol H)
= 24.02 g/mol + 6.06 g/mol + 16.00 g/mol + 1.01 g/mol = 47.09 g/mol
Bước 2: Tính phần trăm khối lượng của mỗi nguyên tố.
- Phần trăm khối lượng của carbon (C) =
- Phần trăm khối lượng của hydrogen (H) =
- Phần trăm khối lượng của oxi (O) =
Vậy, trong hợp chất ethyl alcohol (
), carbon chiếm khoảng 50.91% khối lượng, hydrogen chiếm khoảng 12.82% khối lượng và oxy chiếm khoảng 33.27% khối lượng.
Hợp chất dị vòng
Hợp chất dị vòng (heterocyclic compound) là một loại hợp chất hữu cơ trong hóa học hữu cơ, trong đó cấu trúc phân tử chứa ít nhất một vòng cyclo có chứa các nguyên tố khác nhau. Các vòng dị vòng chứa một hoặc nhiều nguyên tố khác nhau như nitơ (N), oxi (O), lưu huỳnh (S), hoặc phospho (P).
Các hợp chất dị vòng có tính đa dạng và phong phú trong hóa học hữu cơ và có nhiều ứng dụng quan trọng trong lĩnh vực dược phẩm, nông nghiệp, và công nghiệp. Ví dụ phổ biến về hợp chất dị vòng bao gồm các nhóm như pyridine (chứa nguyên tử nitơ), furan (chứa nguyên tử oxi), thiophene (chứa nguyên tử lưu huỳnh), và pyrrole (chứa nguyên tử nitơ và lưu huỳnh).
Hợp chất dị vòng thường có tính chất vật lý và hóa học đặc biệt do sự hiện diện của các nguyên tố khác nhau trong vòng cyclo, và chúng có thể có khả năng tương tác với các phân tử khác một cách độc đáo, làm cho chúng có giá trị trong nghiên cứu và ứng dụng trong nhiều lĩnh vực khoa học và công nghiệp.









