Trong thế giới hóa học, mỗi nguyên tố đều ẩn chứa những câu chuyện thú vị và đóng góp đặc biệt vào sự phát triển của khoa học, công nghệ và nhiều lĩnh vực khác của đời sống. Trong số các kim loại quý, Iridium đứng ra với những tính chất đặc biệt và ứng dụng độc đáo. Bài viết này, yeuhoahoc.edu.vn sẽ giới thiệu sơ lược về nguyên tố Iridium, từ định nghĩa, lịch sử hình thành, đến ứng dụng của nó trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Iridi
Định nghĩa
Iridium, với tên tiếng Anh là “Iridium” và ký hiệu hóa học là “Ir”, là nguyên tố hóa học có số nguyên tử là 77. Nằm trong nhóm kim loại chuyển tiếp và thuộc chu kỳ 6 của bảng tuần hoàn, Iridium là một trong những kim loại cứng, dẻo và có mật độ cao nhất. Đặc biệt, nó nổi bật với khả năng chống ăn mòn vô cùng tốt, thậm chí trong nhiệt độ cao và môi trường hóa học khắc nghiệt.
Lịch sử hình thành nguyên tố Iridi
1803: Smithson Tennant, nhà hóa học người Anh, đã phát hiện ra Iridi trong khi nghiên cứu quặng bạch kim. Ông đã sử dụng phương pháp thủy ngân để chiết xuất kim loại này.
1804: Tennant đặt tên cho nguyên tố mới là Iridi, bắt nguồn từ tiếng Hy Lạp “iris” có nghĩa là “cầu vồng”. Lý do là vì ông nhận thấy các hợp chất của Iridi có nhiều màu sắc khác nhau.
1842: Pierre Berthier, nhà hóa học người Pháp, đã xác định được cấu trúc tinh thể của Iridi.
1904: Henri Moissan, nhà hóa học người Pháp, đã điều chế được Iridi nguyên chất bằng phương pháp điện phân.
Một vài điểm chính trong lịch sử khám phá
- 1803: Smithson Tennant phát hiện ra Iridi.
- 1804: Tennant đặt tên cho nguyên tố mới là Iridi.
- 1842: Pierre Berthier xác định được cấu trúc tinh thể của Iridi.
- 1904: Henri Moissan điều chế được Iridi nguyên chất.
Nguyên tố Iridi trong bảng tuần hoàn hóa học
- Iridi thuộc nhóm 9 (nhóm VIIIB) và chu kỳ 6 trong bảng tuần hoàn hóa học.
- Nó có khối lượng nguyên tử là 192,22 u.
- Iridi là nguyên tố có mật độ cao thứ hai trong tất cả các nguyên tố, sau Osmi, với giá trị 22,56 g/cm³.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 9 | 6 | 192,217(3) | 22,56 | 2719 | 4701 | 0,131 | 2,2 | 0,001 |
Tính chất của nguyên tố Iridi
Tính chất vật lý
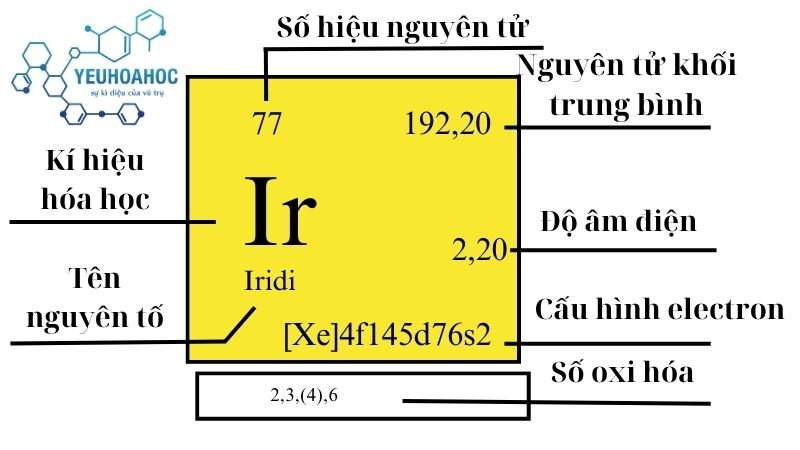
- Ký hiệu: Ir
- Số nguyên tử: 77
- Cấu hình electron: [Xe] 4f14 5d7 6s2
- Khối lượng nguyên tử: 192,22 u
- Điểm nóng chảy: 2466 °C
- Điểm sôi: 4428 °C
- Mật độ: 22,56 g/cm³
- Màu sắc: Trắng bạc
- Cấu trúc tinh thể: Lập phương tâm mặt
- Độ cứng Mohs: 6,5
- Độ dẫn điện: Tốt
- Độ dẫn nhiệt: Tốt
Tính chất hóa học
- Trạng thái oxy hóa: +3, +4, +6
- Tính khử: Yếu
- Tính oxi hóa: Mạnh
- Khả năng chống ăn mòn: Cao
- Phản ứng với axit: Không phản ứng với axit HCl loãng hoặc axit H2SO4 loãng. Phản ứng với axit aqua regia để tạo thành iridi tetroxide (IrO4).
- Phản ứng với kim loại khác: Có thể phản ứng với một số kim loại khác, ví dụ như natri, để tạo thành hợp kim.
- Phản ứng với halogen: Có thể phản ứng với halogen (như clo, brom) ở nhiệt độ cao để tạo thành muối halide.
Ứng dụng của nguyên tố Iridi

Hợp kim
Iridi được sử dụng để làm hợp kim với các kim loại khác như platin, vàng, hoặc tantalum để tăng độ cứng, độ bền và khả năng chống ăn mòn. Hợp kim iridi được sử dụng trong nhiều ngành công nghiệp, bao gồm:
-
- Ngòi bút bi
- Điện cực
- Chân răng giả
- Lò nung
- Bugi
Iridi cũng được sử dụng để làm hợp kim với osmi để tạo ra một trong những hợp kim cứng nhất và chịu mài mòn nhất được biết đến. Hợp kim này được sử dụng trong các dụng cụ cắt và mài.
Điện tử
Iridi được sử dụng để làm điện cực trong các thiết bị điện tử vì nó có khả năng chống ăn mòn cao và dẫn điện tốt.
Iridi cũng được sử dụng để làm lớp phủ cho các vi mạch điện tử để bảo vệ chúng khỏi bị ăn mòn.
Y tế
Iridi được sử dụng trong một số thiết bị y tế, chẳng hạn như máy tạo nhịp tim và cấy ghép, vì nó có khả năng chống ăn mòn cao và tương thích sinh học tốt.
Iridi cũng được sử dụng trong các dụng cụ phẫu thuật vì nó có độ cứng cao và chịu được nhiệt độ cao.
Ngành công nghiệp hóa chất
Iridi được sử dụng làm xúc tác trong một số phản ứng hóa học vì nó có khả năng chống ăn mòn cao và hoạt động xúc tác tốt.
Iridi cũng được sử dụng để làm lớp phủ cho các thiết bị trong ngành công nghiệp hóa chất để bảo vệ chúng khỏi bị ăn mòn.
Ngành công nghiệp ô tô
Iridi được sử dụng làm bugi cho động cơ đốt trong vì nó có khả năng đánh lửa tốt và chịu được nhiệt độ cao.
Iridi cũng được sử dụng làm lớp phủ cho các bộ phận động cơ ô tô để bảo vệ chúng khỏi bị ăn mòn.
Ngoài ra, iridi còn được sử dụng trong một số ứng dụng khác, chẳng hạn như:
- Làm đầu bút kim
- Làm khuôn cho các tinh thể nhân tạo
- Làm vật liệu chịu bức xạ
Điều chế và sản xuất nguyên tố Iridi
Điều chế
Trong phòng thí nghiệm:
- Phương pháp khử:
Khử iridi(IV) chloride (IrCl4) bằng hydro:
IrCl4 + 4H2 -> Ir + 4HCl
Khử iridi(III) oxide (Ir2O3) bằng hydro:
Ir2O3 + 3H2 -> 2Ir + 3H2O
- Phương pháp điện phân:
Điện phân dung dịch iridi(IV) chloride (IrCl4) để tạo ra iridi kim loại:
IrCl4 + 4H2O -> Ir + 4HCl + O2
Trong công nghiệp:
- Iridi được chiết xuất từ quặng niken và đồng. Quặng được nghiền mịn và sau đó được xử lý bằng axit để hòa tan kim loại. Iridi sau đó được kết tủa từ dung dịch axit bằng cách sử dụng một chất khử.
- Iridi cũng có thể được chiết xuất từ quặng platin. Quặng được nung chảy và sau đó được xử lý bằng axit để hòa tan kim loại. Iridi sau đó được kết tủa từ dung dịch axit bằng cách sử dụng một chất khử.
Sản xuất
Iridi được sản xuất bằng cách nung nóng bột iridi trong lò nung ở nhiệt độ cao. Bột iridi được tạo ra bằng cách nghiền mịn iridi kim loại.
Phản ứng của nguyên tố Iridi (Ir)
Phản ứng với axit
- Iridi không phản ứng với axit hydrochloric (HCl) hoặc axit nitric (HNO3) loãng.
- Tuy nhiên, Iridi có thể phản ứng với axit aqua regia (hỗn hợp axit HCl và HNO3 đậm đặc) để tạo thành iridium chloride (IrCl3):
4Ir + 12HCl + 4HNO3 → 4IrCl3 + 12H2O + 4NO2
Phản ứng với oxy
- Iridi không bị oxy hóa trong không khí ở nhiệt độ phòng.
- Tuy nhiên, Iridi có thể phản ứng với oxy ở nhiệt độ cao để tạo thành iridium dioxide (IrO2):
2Ir + O2 → 2IrO2
Phản ứng với kim loại khác
- Iridi có thể hợp kim với các kim loại khác, chẳng hạn như vàng, bạc và bạch kim.
- Hợp kim iridi-bạch kim được sử dụng trong các thiết bị y tế và điện cực.
Phản ứng với halogen
- Iridi có thể phản ứng với halogen, chẳng hạn như clo và brom, ở nhiệt độ cao để tạo thành muối halide:
2Ir + 3Cl2 → 2IrCl3
Ví dụ cụ thể:
- Khi cho bột iridi vào dung dịch axit aqua regia, dung dịch sẽ chuyển sang màu vàng cam do hình thành iridium chloride.
- Khi nung nóng iridi trong không khí ở nhiệt độ cao, iridi sẽ bị oxy hóa và tạo thành một lớp oxit iridi màu đen trên bề mặt.
Vấn đề an toàn của nguyên tố Iridi
Bụi Iridi
- Bụi Iridi có thể gây kích ứng da và mắt.
- Hít phải bụi Iridi có thể gây ra các vấn đề về hô hấp, bao gồm viêm phế quản và hen suyễn.
Iridi tetroxide
- Iridi tetroxide là một hợp chất độc hại có thể gây ra các vấn đề về hô hấp, bao gồm viêm phổi và phù phổi.
- Tiếp xúc với iridi tetroxide cũng có thể gây ra các triệu chứng như ho, khó thở, đau ngực và buồn nôn.
Nguy cơ cháy nổ
- Iridi dạng bột mịn có thể dễ cháy nổ.
Để đảm bảo an toàn khi làm việc với Iridi, cần lưu ý những điều sau:
Hạn chế tiếp xúc với bụi Iridi:
-
- Sử dụng khẩu trang và kính bảo hộ khi làm việc với Iridi.
- Làm việc trong khu vực thông gió tốt.
Tránh tiếp xúc với Iridi tetroxide:
-
- Sử dụng tủ hút khi làm việc với Iridi tetroxide.
- Mang quần áo bảo hộ và găng tay khi tiếp xúc với Iridi tetroxide.
Lưu trữ Iridi an toàn:
-
- Lưu trữ Iridi trong hộp kín ở nơi khô ráo, thoáng mát.
- Giữ Iridi tránh xa các nguồn nhiệt và lửa.
Dưới đây là tổng hợp toàn bộ thông tin cơ bản về nguyên tố Iridi mà chúng tôi đã cung cấp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Iridi. Nếu bạn muốn biết thêm thông tin hoặc có thắc mắc gì, hãy thoải mái đặt câu hỏi trong phần bình luận bên dưới!









