Trong thế giới hóa học, mỗi nguyên tố đều có câu chuyện riêng biệt và đóng góp không nhỏ vào sự phát triển của khoa học và công nghệ. Nguyên tố Osmium, với tên tiếng Anh là “Osmium” và ký hiệu hóa học là “Os”, là một ví dụ điển hình. Bài viết này, yeuhoahoc.edu.vn sẽ cung cấp một cái nhìn toàn diện về nguyên tố Osmium từ định nghĩa, lịch sử hình thành, đến vị trí của nó trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Osmi
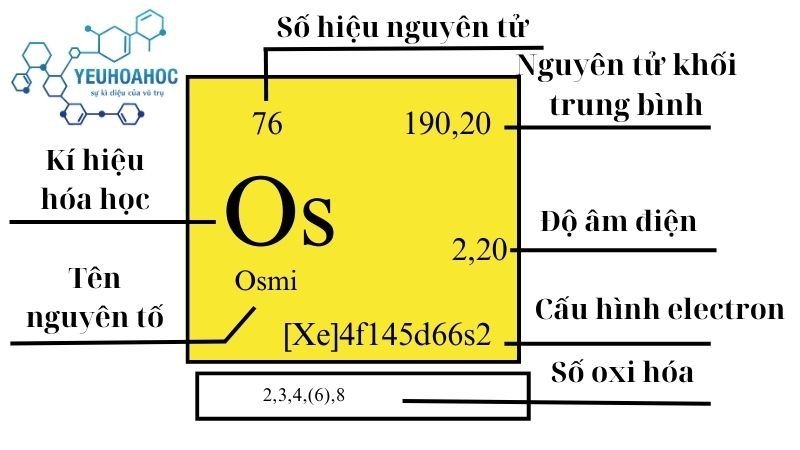
Định nghĩa
Osmium là nguyên tố hóa học có số nguyên tử là 76, thuộc nhóm kim loại chuyển tiếp và nằm trong chu kỳ 6 của bảng tuần hoàn. Đây là một trong những kim loại nặng và cứng nhất, nổi tiếng với khả năng chống ăn mòn và có điểm nóng chảy cao, làm cho nó trở thành một lựa chọn ưu tiên trong nhiều ứng dụng công nghiệp.
Lịch sử hình thành nguyên tố Osmi
1803: Smithson Tennant, nhà hóa học người Anh, đã phát hiện ra Osimi trong khi nghiên cứu quặng bạch kim. Ông đã sử dụng phương pháp thủy ngân để chiết xuất kim loại này.
1804: Tennant đặt tên cho nguyên tố mới là Osimi, bắt nguồn từ tiếng Hy Lạp “osme” có nghĩa là “mùi”. Lý do là vì ông nhận thấy hợp chất osmium tetroxide (OsO4) có mùi hắc khó chịu.
1842: Pierre Berthier, nhà hóa học người Pháp, đã xác định được cấu trúc tinh thể của Osimi.
1904: Henri Moissan, nhà hóa học người Pháp, đã điều chế được Osimi nguyên chất bằng phương pháp điện phân.
Một số mốc thời gian quan trọng trong lịch sử phát hiện
- 1803: Smithson Tennant phát hiện ra Osimi.
- 1804: Tennant đặt tên cho nguyên tố mới là Osimi.
- 1842: Pierre Berthier xác định được cấu trúc tinh thể của Osimi.
- 1904: Henri Moissan điều chế được Osimi nguyên chất.
Nguyên tố Osmi trong bảng tuần hoàn hóa học
- Osimi thuộc nhóm 8 (nhóm VIIIB) và chu kỳ 6 trong bảng tuần hoàn hóa học.
- Nó có số nguyên tử là 76 và khối lượng nguyên tử là 190,23 u.
- Osimi là nguyên tố có mật độ cao nhất trong tất cả các nguyên tố, với giá trị 22,59 g/cm³.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 8 | 6 | 190,23(3) | 22,61 | 3306 | 5285 | 0,13 | 2,2 | 0,002 |
Tầm quan trọng
Khả năng chống ăn mòn và độ cứng cao làm cho osmium trở thành lựa chọn lý tưởng cho nhiều ứng dụng công nghiệp, bao gồm hợp kim bạch kim, các điện cực, và thậm chí trong ngành trang sức. Tuy nhiên, cần phải cẩn trọng với oxit của osmium, osmium tetroxide (OsO4), vì độc tính cao của nó đối với con người và môi trường.
Tính chất của nguyên tố Osmi
Tính chất vật lý
- Mật độ: Osmi là nguyên tố có mật độ cao nhất trong tất cả các nguyên tố, với giá trị 22,59 g/cm³. Điều này có nghĩa là nó nặng hơn 22 lần so với nước.
- Độ cứng: Osimi là một kim loại rất cứng, chỉ đứng sau kim cương và borazon.
- Độ giòn: Osmi cũng là một kim loại giòn, dễ vỡ vụn khi bị va đập mạnh.
- Điểm nóng chảy: Osimi có điểm nóng chảy cao thứ ba trong tất cả các nguyên tố, sau vonfram và carbon, với giá trị 3033 °C.
- Điểm sôi: Osmi có điểm sôi cao thứ hai trong tất cả các nguyên tố, sau vonfram, với giá trị 5027 °C.
- Màu sắc: Osmi có màu trắng xanh lam.
- Trạng thái: Osmi là một chất rắn ở nhiệt độ và áp suất tiêu chuẩn.
Tính chất hóa học
- Kháng ăn mòn: Osmi là một kim loại rất bền và có khả năng chống ăn mòn cao. Nó không bị axit nitric hoặc axit sunfuric tấn công.
- Trạng thái oxy hóa: Osimi có thể tồn tại ở nhiều trạng thái oxy hóa khác nhau, từ -2 đến +8.
- Hợp chất: Osmi có thể tạo thành nhiều hợp chất khác nhau, bao gồm:
- Osmium tetroxide (OsO4): Hợp chất này có mùi hắc khó chịu và có tính độc cao.
- Osmium dioxide (OsO2): Hợp chất này có màu đen và không tan trong nước.
- Osmium trichloride (OsCl3): Hợp chất này có màu đỏ sẫm và tan trong nước.
Ứng dụng của nguyên tố Osmi

Hợp kim chịu nhiệt và chống ăn mòn
- Osmi được sử dụng để chế tạo các hợp kim chịu nhiệt và chống ăn mòn cao, ví dụ như hợp kim được sử dụng trong động cơ máy bay, lò nung, và các thiết bị hóa chất.
- Nhờ khả năng chống ăn mòn tuyệt vời, Osmi được sử dụng để chế tạo các điện cực trong các thiết bị y tế, chẳng hạn như máy tạo nhịp tim và máy khử rung tim.
- Osmi cũng được sử dụng để mạ các bề mặt kim loại khác để tăng khả năng chống ăn mòn của chúng.
Bút bi cao cấp
- Osmi được sử dụng để chế tạo ngòi bút bi cao cấp vì nó có độ cứng cao và không bị mòn.
- Nhờ độ cứng cao, ngòi bút bi làm từ Osmi có thể viết được trên nhiều loại giấy khác nhau mà không bị cong vênh hay gãy.
- Osmi cũng không bị mòn bởi mực bút bi, giúp cho ngòi bút có tuổi thọ cao hơn.
Ngành y tế
- Osmi được sử dụng trong một số lĩnh vực y tế, chẳng hạn như:
- Chẩn đoán và điều trị ung thư: Osmi tetroxide (OsO4) được sử dụng để nhuộm mô trong kính hiển vi điện tử để giúp các bác sĩ chẩn đoán ung thư.
- Cấy ghép: Osmi được sử dụng để chế tạo các ốc vít và đinh vít dùng trong cấy ghép vì nó có khả năng chống ăn mòn cao và tương thích sinh học tốt.
Ngành khoa học
- Osmi được sử dụng trong một số lĩnh vực khoa học, chẳng hạn như:
- Nghiên cứu khoa học vật liệu: Osmi được sử dụng để nghiên cứu các tính chất vật liệu mới, chẳng hạn như độ bền và khả năng chống ăn mòn.
- Hóa học: Osmi được sử dụng để làm xúc tác trong một số phản ứng hóa học.
Các ứng dụng khác
- Osmi được sử dụng để chế tạo các đầu dò trong các thiết bị đo lường, chẳng hạn như máy đo độ dày lớp phủ.
- Osmi được sử dụng để làm vật liệu trang trí, chẳng hạn như nhẫn và vòng cổ.
Điều chế và sản xuất nguyên tố Osmi
Điều chế
- Điều chế trong phòng thí nghiệm:
- Osmi có thể được điều chế trong phòng thí nghiệm bằng cách khử osmium tetroxide (OsO4) bằng hydro hoặc khí amoniac:
Phương trình điều chế:
OsO4 + 4H2 → Os + 4H2O
OsO4 + 2NH3 → Os + 2N2 + 2H2O
- Osmi cũng có thể được điều chế bằng cách điện phân dung dịch natri osmate (Na2OsO4):
Phương trình điều chế:
Na2OsO4 + H2O → Os + 2NaOH + O2
- Điều chế trong công nghiệp:
- Osmi được sản xuất trong công nghiệp chủ yếu từ quặng bạch kim. Quặng bạch kim được nghiền mịn và sau đó được xử lý bằng axit aqua regia để hòa tan kim loại.
- Dung dịch sau đó được khử bằng hydro hoặc khí amoniac để thu được Osmi.
Sản xuất nguyên tố Osmi
Khai thác quặng bạch kim
Quá trình sản xuất Osmium bắt đầu từ việc khai thác quặng bạch kim, nơi nguyên tố này tồn tại cùng với các kim loại quý khác như bạch kim, iridium, palladium, rhodium, và ruthenium. Quặng bạch kim chứa Osmium được khai thác từ các mỏ ở Nga, Nam Phi, và Bắc Mỹ.
Tách quặng và luyện kim
Sau khi quặng được khai thác, nó sẽ trải qua quá trình tách và luyện kim để tách các kim loại quý ra khỏi quặng. Quá trình này thường bao gồm nung nóng quặng trong không khí để tạo thành hợp chất dễ bay hơi của Osmium, osmium tetroxide (OsO₄).
Xử lý osmium tetroxide
Osmium tetroxide là một hợp chất dễ bay hơi và cực kỳ độc hại. Trong quá trình sản xuất, osmium tetroxide được thu hồi và xử lý cẩn thận để tránh rủi ro về sức khỏe. Sau đó, hợp chất này được khử để tạo ra Osmium kim loại.
Khử và tinh chế Osmi
Osimi tetroxide được khử bằng hydrogen hoặc carbon để chuyển đổi trở lại thành Osimi kim loại. Quá trình này thường diễn ra ở nhiệt độ cao trong một lò khử đặc biệt. Osimi kim loại sau đó được tinh chế để loại bỏ bất kỳ tạp chất nào còn sót lại.
Đúc và tạo hình
Osmium kim loại tinh chế có thể được đúc thành các dạng khác nhau tùy thuộc vào mục đích sử dụng cuối cùng, bao gồm dạng tấm, dây, hoặc bột. Do đặc tính cứng và giòn của nó, việc xử lý và tạo hình Osmium đòi hỏi kỹ thuật chuyên môn cao.
Vấn đề an toàn khi sử dụng nguyên tố Osmi

Hít phải
- Osmi dạng bột có thể gây kích ứng phổi và đường hô hấp.
- Hít phải Osimi có thể dẫn đến các triệu chứng như ho, khó thở, đau tức ngực và sốt.
Tiếp xúc da
- Osmi có thể gây kích ứng da và niêm mạc.
- Tiếp xúc da với Osmi có thể dẫn đến các triệu chứng như mẩn đỏ, ngứa, sưng tấy và bỏng rát.
Nuốt phải
- Osmi có thể gây ngộ độc nếu nuốt phải.
- Các triệu chứng ngộ độc Osmi bao gồm buồn nôn, nôn mửa, tiêu chảy, đau bụng, co giật và hôn mê.
Biện pháp an toàn:
- Khi sử dụng Osmi, cần phải đeo găng tay, khẩu trang và kính bảo hộ để tránh tiếp xúc trực tiếp với da và mắt.
- Nên làm việc trong khu vực thông gió tốt để tránh hít phải Osmi dạng bột.
- Cần rửa tay kỹ lưỡng sau khi sử dụng Osmi.
- Nếu nuốt phải Osmi, cần phải đi khám bác sĩ ngay lập tức.
Phản ứng của nguyên tố Osmi (Os)
Phản ứng với oxy
- Osmi có thể phản ứng với oxy ở nhiệt độ cao (trên 200°C) để tạo thành osmi tetroxide (OsO4):
Os + 2O2 -> OsO4
- OsO4 là một hợp chất có màu vàng, dễ bay hơi và có độc tính cao.
Phản ứng với axit
- Osmi không phản ứng với axit HCl loãng hoặc axit H2SO4 loãng. Tuy nhiên, nó có thể phản ứng với axit aqua regia (hỗn hợp axit HCl và axit HNO3) để tạo thành osmi tetroxide:
3Os + 12HCl + 4HNO3 -> 3OsO4 + 12Cl2 + 4NO + 6H2O
Phản ứng với kim loại khác
- Osmi có thể phản ứng với một số kim loại khác, ví dụ như natri, để tạo thành hợp kim:
2Na + Os -> Na2Os
Phản ứng với halogen
- Osmi có thể phản ứng với halogen (như clo, brom) ở nhiệt độ cao để tạo thành muối halide:
Os + 3Cl2 -> OsCl3
Ví dụ cụ thể
- Tác dụng với nước cường toan
Cho một ít bột osmi vào ống nghiệm, sau đó nhỏ thêm vài giọt nước cường toan. Osmi sẽ tan dần trong dung dịch, tạo thành dung dịch có màu vàng cam. Dung dịch này chứa osmi tetroxide, là một hợp chất độc hại.
- Tác dụng với khí clo
Nung nóng một ít bột osmi trong bình kín chứa khí clo. Sau khi phản ứng xảy ra, osmi sẽ kết hợp với clo để tạo thành osmi trichloride (OsCl3), là một hợp chất có màu đen.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Osmi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Osmi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm về sự kì diệu của hóa học, đừng ngần ngại để lại comment dưới đây nhé!









