Nguyên tố Wolfram, là một trong những nguyên tố kim loại nặng, cứng và có điểm nóng chảy cao nhất trong số các nguyên tố tinh khiết. Sở hữu những đặc tính vật lý và hóa học độc đáo, Wolfram đóng một vai trò quan trọng trong nhiều ứng dụng công nghệ và công nghiệp. Bài viết này, yeuhoahoc.edu.vn sẽ mang đến cái nhìn sâu sắc về định nghĩa, lịch sử hình thành và vị trí của Wolfram trong bảng tuần hoàn hóa học.
Giới thiệu về nguyên tố Wolfram
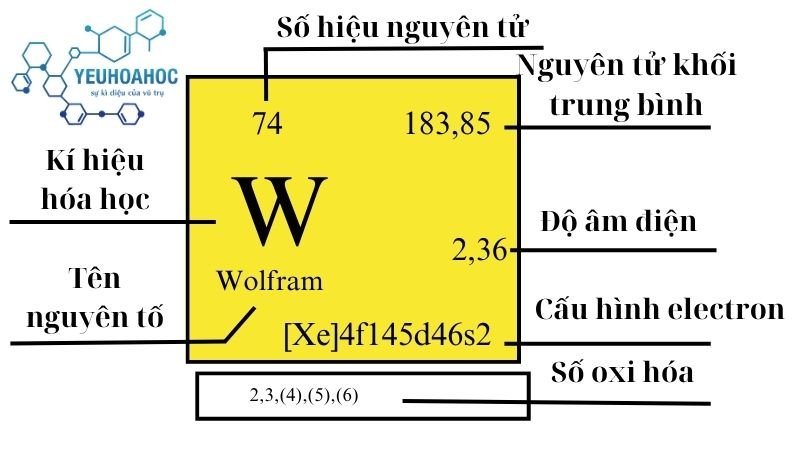
Định nghĩa
Wolfram (tên tiếng Anh: Tungsten, ký hiệu: W) là một nguyên tố hóa học có số nguyên tử 74. Nó là một kim loại chuyển tiếp màu xám, cứng và có khả năng chống ăn mòn cao. Wolfram được xếp vào nhóm VIB trong bảng tuần hoàn hóa học.
Lịch sử hình thành nguyên tố Wolfram
- 1783: Juan José Elhuyar và Fausto Elhuyar, hai nhà hóa học người Tây Ban Nha, phát hiện ra Wolfram trong khoáng vật wolframite.
- 1783: Carl Wilhelm Scheele, nhà hóa học người Thụy Điển, cũng phát hiện ra Wolfram một cách độc lập.
- 1783: Peter Woulfe, nhà hóa học người Anh, xác định rằng Wolfram là một nguyên tố mới.
- 1796: Johann Gottfried Lehmann đặt tên cho nguyên tố này là Wolfram, theo tiếng Đức có nghĩa là “bọt sói”.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1783: Wolfram được phát hiện bởi Juan José Elhuyar và Fausto Elhuyar.
- 1783: Carl Wilhelm Scheele cũng phát hiện ra Wolfram một cách độc lập.
- 1783: Peter Woulfe xác định rằng Wolfram là một nguyên tố mới.
- 1796: Johann Gottfried Lehmann đặt tên cho nguyên tố này là Wolfram.
- 1803: Anders Gustaf Ekeberg xác định rằng wolframite là quặng chính của Wolfram.
- 1847: Robert Bunsen và Henry Enfield Roscoe phát triển phương pháp sản xuất Wolfram tinh khiết.
- 1903: William Coolidge sử dụng Wolfram để làm dây tóc bóng đèn.
- 1922: Wolfram được sử dụng trong các hợp kim chịu nhiệt.
- 1950: Wolfram được sử dụng trong các thiết bị y tế.
Nguyên tố Wolfram trong bảng tuần hoàn hóa học
- Ký hiệu: W
- Số nguyên tử: 74
- Cấu hình electron: [Xe] 4f14 5d3 6s2
- Khối lượng nguyên tử: 180,94788 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 6 | 6 | 183,84(1) | 19,25 | 3695 | 5828 | 0,132 | 2,36 | 1,3 |
Tính chất của nguyên tố Wolfram
Tính chất vật lý
- Màu sắc: Xám
- Trạng thái: Rắn
- Cấu trúc tinh thể: Lập phương tâm khối
- Khối lượng riêng: 19,25 g/cm³
- Điểm nóng chảy: 3422 °C
- Điểm sôi: 5555 °C
- Độ dẫn điện: Tốt
- Độ dẫn nhiệt: Tốt
- Tính dẻo: Dẻo
- Độ cứng: Cứng
- Khả năng chống ăn mòn: Cao
Tính chất hóa học
- Hóa trị: +6, +5, +4, +3, +2
- Tính khử: Yếu
- Tính oxi hóa: Trung bình
- Phản ứng với axit: Phản ứng với axit loãng để tạo thành muối wolfram
- Phản ứng với bazơ: Không phản ứng với bazơ
- Phản ứng với nước: Không phản ứng với nước
- Phản ứng với oxy: Phản ứng với oxy ở nhiệt độ cao để tạo thành oxit wolfram
Một số hợp chất quan trọng của Wolfram
- Wolfram(VI) chloride (WCl6): Chất rắn màu vàng, tan trong nước
- Wolfram(VI) fluoride (WF6): Chất khí không màu, tan trong nước
- Wolfram(VI) oxit (WO3): Chất rắn màu vàng, không tan trong nước
- Wolfram(VI) hydroxide (WO3·xH2O): Chất rắn màu vàng, không tan trong nước
Ứng dụng của nguyên tố Wolfram (Vonfram)

Hợp kim
- Wolfram được sử dụng để chế tạo các hợp kim có độ bền cao, chịu nhiệt tốt và chống ăn mòn.
- Các hợp kim Wolfram được sử dụng trong nhiều lĩnh vực như:
- Hàng không vũ trụ
- Công nghiệp ô tô
- Ngành công nghiệp khai thác
- Dụng cụ y tế
Dụng cụ y tế
- Wolfram được sử dụng để chế tạo các dụng cụ y tế như:
- Máy móc chẩn đoán hình ảnh
- Cấy ghép y tế
- Dao mổ
- Kim châm
Điện tử
- Wolfram được sử dụng để chế tạo các linh kiện điện tử như:
- Dây điện
- Tiếp điểm
- Điện trở
- Tụ điện
Chống bức xạ
- Wolfram có khả năng hấp thụ bức xạ tốt nên được sử dụng để chế tạo các tấm chắn bức xạ trong các lĩnh vực như:
- Y tế
- Năng lượng hạt nhân
- Công nghiệp
Năng lượng
- Wolfram được sử dụng trong các lò phản ứng hạt nhân để làm nhiên liệu và vật liệu chế tạo các bộ phận chịu nhiệt.
Ngoài ra, Wolfram còn được sử dụng trong nhiều ứng dụng khác như:
- Sản xuất bóng đèn
- Chế tạo bút bi
- Dụng cụ thể thao
- Trang sức
Điều chế và sản xuất nguyên tố Wolfram (Vonfram)
Điều chế
Trong phòng thí nghiệm:
- Phương pháp khử hydro:
- Wolfram được điều chế bằng cách khử hydro từ wolfram trioxide (WO3) bằng khí hydro.
- Phản ứng xảy ra ở nhiệt độ cao (khoảng 1000°C).
- Phương trình phản ứng:
WO3 + 3H2 → W + 3H2O
- Phương pháp điện giải:
- Wolfram cũng có thể được điều chế bằng phương pháp điện giải dung dịch muối wolfram.
- Phương pháp này thường được sử dụng để tạo ra các lớp phủ wolfram mỏng.
Trong công nghiệp:
- Phương pháp khử hydro:
- Phương pháp khử hydro được sử dụng để sản xuất wolfram ở quy mô lớn.
- Quặng wolfram được nghiền mịn và nung nóng để loại bỏ tạp chất.
- Sau đó, wolfram trioxide được khử hydro bằng khí hydro để tạo ra wolfram kim loại.
Sản xuất
- Wolfram được sản xuất chủ yếu ở Trung Quốc, Nga và Áo.
- Quá trình sản xuất wolfram bao gồm các bước sau:
- Khai thác quặng wolfram
- Nung nóng quặng wolfram để loại bỏ tạp chất
- Khử wolfram trioxide bằng khí hydro để tạo ra wolfram kim loại
Phản ứng hóa học của nguyên tố Wolfram (Vonfram)

Phản ứng với axit
- Wolfram không phản ứng với axit HCl và H2SO4 loãng ở nhiệt độ thường.
- Wolfram phản ứng với axit HNO3 đặc nóng để tạo thành WO3:
2W + 10HNO3 → WO3 + 10NO2 + 5H2O
- Wolfram phản ứng với axit HF đặc nóng để tạo thành WF6:
W + 6HF → WF6 + 3H2
Phản ứng với oxy
- Wolfram không phản ứng với oxy ở nhiệt độ thường.
- Wolfram phản ứng với oxy khi nung nóng để tạo thành WO3:
2W + 3O2 → WO3
Phản ứng với kim loại khác
- Wolfram không phản ứng với hầu hết các kim loại khác ở nhiệt độ thường.
- Wolfram phản ứng với một số kim loại kiềm như Li và Na khi nung nóng để tạo thành hợp kim:
2W + 6Li → Li3W2
Phản ứng với halogen
- Wolfram phản ứng với flo khi nung nóng để tạo thành WF6:
W + 6F2 → WF6
- Wolfram không phản ứng với clo, brom và iốt ở nhiệt độ thường.
Ví dụ cụ thể:
- Phản ứng của Wolfram với axit nitric:
2W + 10HNO3 → WO3 + 10NO2 + 5H2O
- Phản ứng của Wolfram với oxy khi nung nóng:
2W + 3O2 → WO3
- Phản ứng của Wolfram với flo khi nung nóng:
W + 6F2 → WF6
Vấn đề an toàn khi sử dụng nguyên tố Wolfram (Vonfram)
Bụi Wolfram
- Bụi Wolfram có thể gây kích ứng da, mắt và hệ hô hấp.
- Các triệu chứng kích ứng da bao gồm mẩn đỏ, ngứa và sưng tấy.
- Các triệu chứng kích ứng mắt bao gồm chảy nước mắt, đỏ mắt và mờ mắt.
- Các triệu chứng kích ứng hệ hô hấp bao gồm ho, khó thở và tức ngực.
Hợp chất Wolfram
- Một số hợp chất Wolfram, chẳng hạn như Wolfram hexafluoride (WF6), có thể gây độc.
- WF6 là một khí độc có thể gây tổn thương phổi.
- Các triệu chứng ngộ độc WF6 bao gồm ho, khó thở, đau ngực và co giật.
Wolfram dạng nano
- Wolfram dạng nano có thể có những nguy cơ tiềm ẩn chưa được biết đến.
- Một số nghiên cứu cho thấy Wolfram dạng nano có thể gây hại cho tế bào.
Biện pháp phòng ngừa
Khi sử dụng Wolfram, cần tuân thủ các biện pháp phòng ngừa sau:
-
- Tránh hít phải bụi Wolfram.
- Tránh tiếp xúc với da và mắt.
- Làm việc trong khu vực thông gió tốt.
- Sử dụng các biện pháp bảo hộ cá nhân, chẳng hạn như găng tay, khẩu trang và kính bảo hộ.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Wolfram mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Wolfram. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









