Hafni, nguyên tố hóa học với số nguyên tử 72, được đặt tên theo Hafnia, tên Latin cổ của Copenhagen, Đan Mạch. Sự khám phá của Hafnium là kết quả của nghiên cứu sâu rộng vào cấu trúc của các nguyên tố và sự tìm kiếm các nguyên tố mới trong bảng tuần hoàn. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về Hafni, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Hafni
Định nghĩa
Hafni (Hafnium) là một nguyên tố hóa học có ký hiệu Hf và số nguyên tử 72. Nó là một kim loại chuyển tiếp màu trắng bạc, cứng và có khả năng chống ăn mòn cao. Hafni được xếp vào nhóm IVB trong bảng tuần hoàn hóa học
Lịch sử hình thành nguyên tố Hafni
1923: Niels Bohr, nhà vật lý người Đan Mạch, dự đoán sự tồn tại của một nguyên tố mới có số nguyên tử 72.
1923: Dirk Coster và George de Hevesy, hai nhà khoa học người Hà Lan, đã phát hiện ra Hafni trong quặng zirconium. Họ đặt tên cho nguyên tố này theo tên thành phố Copenhagen của Đan Mạch, Hafnia, trong tiếng Latinh.
1924: Hafni được xác nhận là một nguyên tố mới.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1923: Niels Bohr dự đoán sự tồn tại của Hafni.
- 1923: Dirk Coster và George de Hevesy phát hiện ra Hafni.
- 1924: Hafni được xác nhận là một nguyên tố mới.
- 1940: Hafni được sử dụng trong các thanh điều khiển lò phản ứng hạt nhân.
- 1950: Hafni được sử dụng trong các hợp kim để cải thiện độ bền và khả năng chống ăn mòn.
- 1970: Hafni được sử dụng trong các thiết bị laser.
Nguyên tố Hafni trong bảng tuần hoàn hóa học
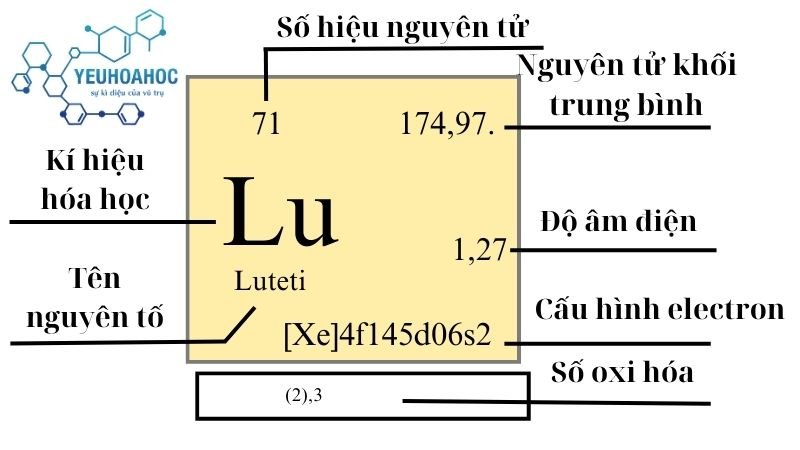
- Ký hiệu: Hf
- Số nguyên tử: 72
- Cấu hình electron: [Xe] 4f14 5d2 6s2
- Khối lượng nguyên tử: 178,492 u
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 4 | 6 | 178,49(2) | 13,31 | 2506 | 4876 | 0,144 | 1,3 | 3 |
Tính chất của nguyên tố Hafni
Tính chất vật lý
- Màu sắc: Xám bạc
- Trạng thái: Rắn
- Cấu trúc tinh thể: Lập phương tâm khối
- Khối lượng riêng: 13,31 g/cm³
- Điểm nóng chảy: 2233 °C
- Điểm sôi: 5400 °C
- Độ dẫn điện: Tốt
- Độ dẫn nhiệt: Tốt
- Tính dẻo: Dẻo
- Độ cứng: Cứng
- Khả năng chống ăn mòn: Tốt
Tính chất hóa học
- Hóa trị: +4
- Tính khử: Trung bình
- Tính oxi hóa: Yếu
- Phản ứng với axit: Phản ứng với axit loãng để tạo thành muối hafni
- Phản ứng với bazơ: Không phản ứng với bazơ
- Phản ứng với nước: Phản ứng chậm với nước để tạo thành hydroxide hafni
- Phản ứng với oxy: Phản ứng với oxy ở nhiệt độ cao để tạo thành oxit hafni
Một số hợp chất quan trọng của Hafni
- Hafni(IV) chloride (HfCl4): Chất rắn màu trắng, tan trong nước
- Hafni(IV) fluoride (HfF4): Chất rắn màu trắng, không tan trong nước
- Hafni(IV) oxit (HfO2): Chất rắn màu trắng, không tan trong nước
- Hafni(IV) hydroxide (Hf(OH)4): Chất rắn màu trắng, không tan trong nước
Ứng dụng của nguyên tố Hafni
Lò phản ứng hạt nhân
- Hafni được sử dụng trong các thanh điều khiển lò phản ứng hạt nhân vì khả năng hấp thụ neutron cao của nó.
- Hợp kim hafni-zirconium được sử dụng để làm vỏ bọc cho thanh nhiên liệu hạt nhân.
Hợp kim
- Hafni được thêm vào các hợp kim để cải thiện độ bền, khả năng chống ăn mòn và khả năng chịu nhiệt.
- Hợp kim hafni-niobi được sử dụng trong các động cơ máy bay và các bộ phận chịu nhiệt khác.
- Hợp kim hafni-tantalum được sử dụng trong các thiết bị y tế và các ứng dụng công nghiệp khác.
Thiết bị laser
- Hafni được sử dụng trong các thiết bị laser vì khả năng dẫn nhiệt cao của nó.
- Hợp kim hafni-yttri được sử dụng để làm gương cho các laser công suất cao.
Y học
- Hafni được sử dụng trong một số thiết bị y tế như máy chụp X-quang và máy MRI.
- Hafni-177, một đồng vị phóng xạ của hafni, được sử dụng để điều trị ung thư.
Điều chế và sản xuất nguyên tố Hafni
Điều chế
Điều chế trong phòng thí nghiệm:
- Phương pháp khử hydro hóa:
Hafni có thể được điều chế bằng cách khử hydro hóa hafni(IV) hydride (HfH4). Ví dụ:
HfH4 + 2H2 → Hf + 4H2
- Phương pháp điện phân:
Hafni cũng có thể được điều chế bằng cách điện phân dung dịch muối hafni. Ví dụ:
HfCl4(aq) → Hf(s) + 4Cl2(g)
Điều chế trong công nghiệp:
- Phương pháp chiết xuất từ quặng zircon:
Hafni được sản xuất chủ yếu từ quặng zircon, một loại khoáng chất chứa nhiều nguyên tố đất hiếm. Quặng zircon được nghiền mịn và xử lý bằng axit để hòa tan các kim loại. Hafni sau đó được chiết xuất từ dung dịch bằng các phương pháp hóa học như trao đổi ion hoặc kết tủa.
- Phương pháp khử hydro hóa:
Hafni cũng có thể được điều chế bằng cách khử hydro hóa hafni(IV) hydride (HfH4).
Sản xuất
Sản xuất nguyên tố Hafnium (Hf) thường liên quan đến quá trình tách Hafnium ra khỏi Zirconium, vì hai nguyên tố này có tính chất hóa học tương tự nhau và thường xuất hiện cùng nhau trong tự nhiên.
Khai thác và tinh chế Zircon (ZrSiO4): Nguyên liệu chính để sản xuất Hafnium là khoáng vật Zircon. Khoáng vật này được khai thác, sau đó được xử lý qua nhiều bước để tinh chế, loại bỏ các tạp chất và thu được sản phẩm là Zirconium oxychloride (ZrOCl2).
Tách Zirconium và Hafnium: Một phương pháp phổ biến để tách hai nguyên tố này là sử dụng quy trình chiết rút bằng dung môi, trong đó hafnium và zirconium được hòa tan trong dung môi thích hợp (ví dụ, axit hydrochloric). Sau đó, chất chiết hafnium được tách ra khỏi dung dịch.
Tinh chế Hafnium: Hafnium thu được sau quá trình tách từ Zirconium cần được tinh chế thêm để loại bỏ các tạp chất. Quá trình này có thể bao gồm việc tái chiết, kết tủa, và chưng cất.
Chuyển hóa Hafnium thành dạng sử dụng: Hafnium tinh chế có thể được chuyển hóa thành dạng kim loại bằng quá trình nhiệt phân hoặc qua phản ứng với các khí như khí argon trong một lò nhiệt độ cao.
Phản ứng của nguyên tố Hafni (Hafnium)

Phản ứng với axit
Hafni phản ứng với axit loãng để tạo thành muối hafni.
Ví dụ:
Hf(s) + 2HCl(aq) → HfCl2(aq) + H2(g)
Phản ứng với nước
Hafni phản ứng chậm với nước để tạo thành hydroxide hafni.
Ví dụ:
Hf(s) + 2H2O(l) → Hf(OH)4(s) + H2(g)
Phản ứng với oxy
Hafni phản ứng với oxy ở nhiệt độ cao để tạo thành oxit hafni.
Ví dụ:
Hf(s) + O2(g) → HfO2(s)
Phản ứng với halogen
Hafni phản ứng với halogen (như F2, Cl2, Br2) để tạo thành muối halogenua hafni.
Ví dụ:
Hf(s) + 2F2(g) → HfF4(s)
Phản ứng với dung dịch kiềm
Hafni không phản ứng với dung dịch kiềm.
Vấn đề an toàn khi sử dụng nguyên tố Hafni
Nguy cơ ngộ độc
- Hafni có thể gây ngộ độc nếu nuốt phải hoặc hít phải.
- Các triệu chứng ngộ độc hafni bao gồm buồn nôn, nôn mửa, tiêu chảy, đau bụng, yếu cơ và co giật.
- Nếu nghi ngờ ngộ độc hafni, cần phải đến gặp bác sĩ ngay lập tức.
Kích ứng da và mắt
- Hafni có thể gây kích ứng da và mắt.
- Các triệu chứng kích ứng da bao gồm mẩn đỏ, ngứa và sưng tấy.
- Các triệu chứng kích ứng mắt bao gồm chảy nước mắt, đỏ mắt và ngứa mắt.
- Nếu hafni dính vào da hoặc mắt, cần rửa sạch ngay với nước.
Nguy cơ cháy nổ
- Bột hafni mịn có thể bắt lửa và nổ nếu tiếp xúc với lửa hoặc tia lửa.
- Cần phải bảo quản hafni ở nơi khô ráo, thoáng mát, tránh xa các nguồn nhiệt và tia lửa.
Biện pháp phòng ngừa
- Khi sử dụng hafni, cần phải đeo găng tay, khẩu trang và kính bảo hộ để không bị dính vào da và mắt.
- Cần phải làm việc trong khu vực thông gió tốt để tránh hít phải bụi hafni.
- Cần phải bảo quản hafni ở nơi an toàn, tránh xa tầm tay trẻ em.
Xử lý hafni thải loại
- Hafni thải loại cần được xử lý theo quy định của địa phương.
- Không được vứt hafni thải loại xuống cống rãnh hoặc sông suối.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Hafni mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Hafni. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









