Trong thế giới huyền bí của các nguyên tố đất hiếm, Samarium nổi bật như một nguyên tố có tính chất đặc biệt và ứng dụng phong phú. Từ lịch sử phát hiện đến vị trí của nó trong bảng tuần hoàn hóa học, Samarium là một chủ đề hấp dẫn cho những ai quan tâm đến khoa học vật liệu và công nghệ. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về Samari, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Samari
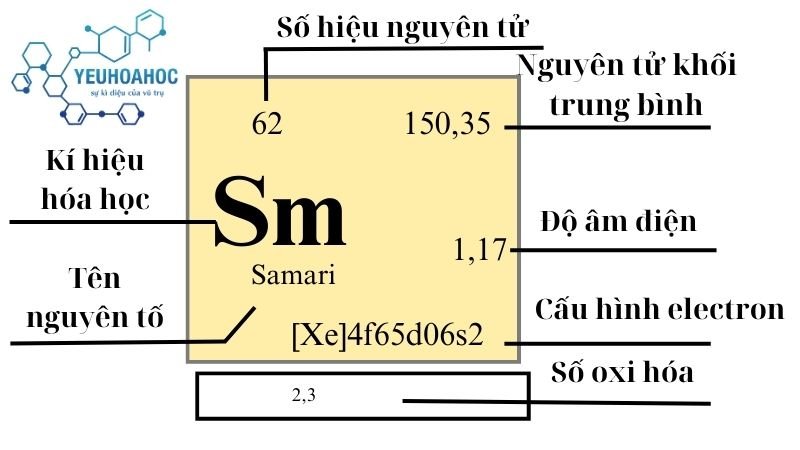
Định nghĩa
- Samari, với tên tiếng Anh là “Samarium” và kí hiệu hóa học là “Sm”, là nguyên tố hóa học có số nguyên tử là 62. Nó thuộc nhóm các nguyên tố đất hiếm và là một phần của chuỗi Lanthanide trong bảng tuần hoàn. Samarium nổi bật với khả năng tạo thành nam châm vĩnh cửu, cũng như ứng dụng trong y học và công nghiệp.
Lịch sử hình thành nguyên tố Samari
- Samari được phát hiện vào năm 1879 bởi nhà hóa học người Pháp Paul-Émile Lecoq de Boisbaudran.
- Ông đã phát hiện ra samari bằng cách phân tích quang phổ của quặng didymium.
- Tên “samari” được đặt theo tên của một loại khoáng chất được tìm thấy ở Samarskaya Oblast, Nga.
Một số mốc thời gian quan trọng trong lịch sử phát hiện
- 1879: Samari được phát hiện bởi Paul-Émile Lecoq de Boisbaudran.
- 1901: Samari được xác định là một nguyên tố riêng biệt.
- 1945: Samari được sử dụng lần đầu tiên trong các lò phản ứng hạt nhân.
- 1960: Samari được sử dụng trong các nam châm vĩnh cửu.
Nguyên tố Samari trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn, Samarium chiếm vị trí số 62, giữa Promethium và Europium, thuộc nhóm nguyên tố Lanthanide. Tính chất đặc biệt của Samarium, bao gồm từ tính mạnh và khả năng phát xạ gamma, làm cho nó trở thành nguyên tố quan trọng trong nhiều lĩnh vực ứng dụng.
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 6 | 150,36(2) | 7,52 | 1345 | 2067 | 0,197 | 1,17 | 7,05 |
Tính chất của nguyên tố Samari
Tính chất vật lý
- Ký hiệu: Sm
- Số nguyên tử: 62
- Khối lượng nguyên tử: 150,36 u
- Cấu hình electron: [Xe] 4f6 6s2
- Trạng thái: Rắn
- Màu: Trắng bạc
- Điểm nóng chảy: 1072 °C
- Điểm sôi: 1794 °C
- Tỷ khối: 7,52 g/cm³
- Tính dẫn điện: Dẫn điện tốt
- Tính dẫn nhiệt: Dẫn nhiệt tốt
Tính chất hóa học
- Trạng thái oxy hóa: +2, +3
- Độ âm điện: 1,17
- Tính khử: Khử mạnh
- Tính oxy hóa: Oxy hóa yếu
- Phản ứng với nước: Phản ứng chậm với nước để tạo thành samari hydroxit
- Phản ứng với axit: Phản ứng với axit để tạo thành muối samari
- Phản ứng với oxy: Phản ứng với oxy để tạo thành samari oxit
- Hợp chất: Samari tạo thành nhiều hợp chất khác nhau, bao gồm oxit, hydroxit, halide, cacbonat, sulfat, và nitrat.
Một số tính chất đặc trưng:
- Samari là một kim loại đất hiếm.
- Samari có tính khử mạnh.
- Samari có khả năng phát ra ánh sáng trong bóng tối.
- Samari được sử dụng trong một số ứng dụng khác nhau, bao gồm:
- Lò phản ứng hạt nhân
- Nam châm vĩnh cửu
- Laser
- Hợp kim
Lưu ý:
- Samari là một nguyên tố tương đối an toàn để sử dụng.
- Tuy nhiên, cần cẩn thận khi sử dụng samari dạng bột vì nó có thể dễ dàng bắt lửa.
- Nên tham khảo ý kiến chuyên gia trước khi sử dụng samari trong các ứng dụng cụ thể.
Ứng dụng của nguyên tố Samari

Lò phản ứng hạt nhân
- Samari được sử dụng trong các lò phản ứng hạt nhân để điều khiển tốc độ phản ứng phân hạch.
- Samari có khả năng hấp thụ neutron, giúp làm chậm tốc độ phản ứng phân hạch.
Nam châm vĩnh cửu
- Samari được sử dụng để chế tạo nam châm vĩnh cửu có từ tính mạnh.
- Nam châm samari được sử dụng trong nhiều thiết bị khác nhau, bao gồm động cơ điện, máy phát điện, và tai nghe.
Laser
- Samari được sử dụng để chế tạo laser có hiệu suất cao.
- Laser samari được sử dụng trong nhiều ứng dụng khác nhau, bao gồm y tế, công nghiệp và khoa học.
Hợp kim
- Samari được sử dụng để chế tạo hợp kim có độ bền cao và khả năng chống ăn mòn tốt.
- Hợp kim samari được sử dụng trong nhiều ứng dụng khác nhau, bao gồm hàng không vũ trụ, ô tô và y tế.
Y tế
- Samari được sử dụng trong một số phương pháp điều trị y tế, bao gồm:
- Điều trị ung thư
- Chẩn đoán bệnh
- Giảm đau
Các ứng dụng khác
- Samari được sử dụng trong một số ứng dụng khác, bao gồm:
- Pin nhiên liệu
- Điện tử
- Kính quang học
Điều chế và sản xuất nguyên tố Samari
Điều chế
Điều chế trong phòng thí nghiệm:
- Samari có thể được điều chế trong phòng thí nghiệm bằng phương pháp khử samari oxit bằng hydro:
Sm2O3 + 3H2 → 2Sm + 3H2O
- Phương pháp này thường được sử dụng để điều chế samari tinh khiết.
Điều chế trong công nghiệp:
- Samari được sản xuất trong công nghiệp bằng phương pháp chiết xuất từ quặng monazit và bastnäsite.
- Quặng được nghiền mịn và xử lý bằng axit để hòa tan các kim loại đất hiếm.
- Dung dịch sau đó được xử lý bằng các phương pháp hóa học để tách samari ra khỏi các kim loại đất hiếm khác.
Phương trình điều chế:
- Quá trình chiết xuất samari từ quặng monazit và bastnäsite khá phức tạp và bao gồm nhiều bước.
- Dưới đây là một số phương trình điều chế chính:
(1) Monazit + H2SO4 → Sm2(SO4)3 + …
(2) Sm2(SO4)3 + NaOH → Sm(OH)3 + …
(3) Sm(OH)3 + HCl → SmCl3 + …
(4) SmCl3 + Mg → Sm + MgCl2
Sản xuất
- Samari được sản xuất trên toàn thế giới với sản lượng hàng năm khoảng 700 tấn.
- Trung Quốc là nhà sản xuất samari lớn nhất thế giới.
- Samari được sử dụng trong nhiều ứng dụng khác nhau, bao gồm:
- Lò phản ứng hạt nhân
- Nam châm vĩnh cửu
- Laser
- Hợp kim
Phản ứng của nguyên tố Samari
Samari là một kim loại đất hiếm có tính khử mạnh. Nó có thể phản ứng với nhiều chất khác nhau, bao gồm:
Nước
Samari phản ứng chậm với nước để tạo thành samari hydroxit:
2Sm + 6H2O → 2Sm(OH)3 + 3H2
Axit
Samari phản ứng với axit để tạo thành muối samari:
Sm + 2HCl → SmCl2 + H2
Oxy
Samari phản ứng với oxy để tạo thành samari oxit:
4Sm + 3O2 → 2Sm2O3
Halogen
Samari phản ứng với halogen để tạo thành muối halogenua:
2Sm + 3F2 → 2SmF3
Kim loại khác
Samari phản ứng với kim loại khác để tạo thành hợp kim:
Sm + Mg → SmMg2
Ví dụ cụ thể:
- Samari có thể được sử dụng để khử hydro từ nước:
2Sm + 6H2O → 2Sm(OH)3 + 3H2
- Samari có thể được sử dụng để khử oxy từ oxit:
Sm + 2Fe2O3 → 2Sm2O3 + 4Fe
- Samari có thể được sử dụng để khử halogen từ muối halogenua:
Sm + 2AgCl → SmCl2 + 2Ag
- Samari có thể được sử dụng để chế tạo hợp kim:
Sm + Mg → SmMg2
Vấn đề an toàn khi sử dụng nguyên tố Samari
Bức xạ
Samari phát ra tia beta và tia gamma, có thể gây hại cho sức khỏe con người.
- Tiếp xúc với tia beta có thể gây bỏng da và tổn thương mắt.
- Tiếp xúc với tia gamma có thể gây ung thư và các bệnh khác.
Nguy cơ ô nhiễm
Samari là một nguyên tố nhân tạo và không có trong tự nhiên.
- Nếu Samari bị rò rỉ ra môi trường, nó có thể gây ô nhiễm môi trường và ảnh hưởng đến sức khỏe con người.
Nguy cơ hỏa hoạn
Samari có thể dễ dàng bắt lửa và cháy trong không khí.
- Cần cẩn thận khi sử dụng Samari gần nguồn nhiệt.
Biện pháp an toàn
- Cần tuân thủ các quy định an toàn khi làm việc với Samari.
- Nên đeo găng tay, kính bảo hộ và quần áo bảo hộ khi làm việc với Samari.
- Nên làm việc với Samari trong khu vực thông gió tốt.
- Cần có sẵn bình chữa cháy hoặc các phương tiện chữa cháy khác khi làm việc với Samari.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Samari mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Samari. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









