Trong vương quốc rộng lớn của bảng tuần hoàn hóa học, nguyên tố Praseodymi nổi bật như một kho báu với những tính chất và ứng dụng đặc biệt. Từ lịch sử phát hiện đến vị trí quan trọng trong bảng tuần hoàn, Praseodymi mang lại cái nhìn sâu sắc vào thế giới nguyên tố hóa học và vai trò của chúng trong đời sống hiện đại. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp cái nhìn tổng quan về Praseodymi, bao gồm định nghĩa, lịch sử, tính chất, ứng dụng, điều chế, và vấn đề an toàn liên quan.
Giới thiệu về nguyên tố Praseodymi
Định nghĩa
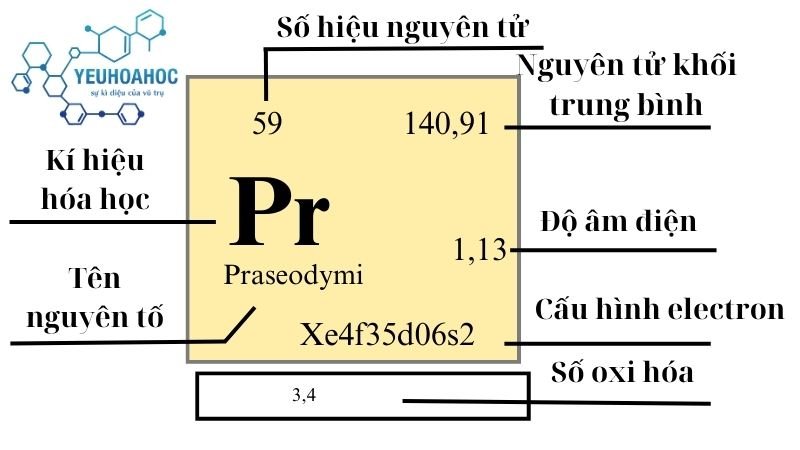
Praseodymi, với tên tiếng Anh là “Praseodymium” và kí hiệu hóa học là “Pr”, là nguyên tố hóa học với số nguyên tử là 59. Nằm trong nhóm các nguyên tố đất hiếm và là một phần của chuỗi Lanthanide, Praseodymi được biết đến với màu vàng xanh đặc trưng và tính chất hóa học độc đáo.
Lịch sử hình thành nguyên tố Praseodymi
- Năm 1841: Carl Gustav Mosander, một nhà hóa học Thụy Điển, đã phát hiện ra didymium, một nguyên tố đất hiếm mới.
- Năm 1885: Carl Auer von Welsbach, một nhà hóa học Áo, đã phân tách didymium thành hai nguyên tố riêng biệt: praseodymium và neodymium.
- Tên praseodymium có nguồn gốc từ tiếng Hy Lạp “prasios” (màu xanh lá cây) và “didymos” (sinh đôi), vì nó được phân tách từ didymium và có một số muối có màu xanh lục.
Một số mốc thời gian quan trọng trong lịch sử phát hiện:
- 1841: Carl Gustav Mosander phát hiện ra didymium.
- 1879: Lecoq de Boisbaudran đề xuất rằng didymium là một hỗn hợp của hai nguyên tố.
- 1885: Carl Auer von Welsbach phân tách didymium thành praseodymium và neodymium.
- 1925: Bohr đề xuất cấu hình electron cho praseodymium.
- 1945: Sử dụng praseodymium trong các hợp kim để cải thiện độ bền và khả năng chống ăn mòn.
- 1960: Sử dụng praseodymium trong các ứng dụng y tế, như điều trị bệnh Gaucher.
Nguyên tố Praseodymi trong bảng tuần hoàn hóa học
- Thuộc nhóm Lanthanide (nhóm 3)
- Chu kỳ 6
| Nhóm | Chu kỳ | Nguyên tử khối (u) | Khối lượng riêng g/cm3 | Nhiệt độ nóng chảy (K9) | Nhiệt độ bay hơi
K |
Nhiệt dung riêng
J/g.K |
Độ âm điện | Tỷ lệ trong vỏ Trái Đất
mg/kg |
| 6 | 140,90765(2) | 6,773 | 1208 | 3793 | 0,193 | 1,13 | 9,2 |
Tính chất của nguyên tố Praseodymi
Tính chất vật lý
- Ký hiệu: Pr
- Số nguyên tử: 59
- Khối lượng nguyên tử: 140,90765(2) u
- Cấu hình electron: [Xe] 4f3 6s2
- Trạng thái: Rắn
- Màu: Bạc trắng
- Điểm nóng chảy: 931 °C
- Điểm sôi: 3520 °C
- Tỷ khối: 6,77 g/cm³
- Tính dẫn điện: Dẫn điện tốt
- Tính dẫn nhiệt: Dẫn nhiệt tốt
Tính chất hóa học
- Trạng thái oxy hóa: +3, +4
- Độ âm điện: 1,13
- Tính khử: Khử mạnh
- Tính oxy hóa: Oxy hóa yếu
- Phản ứng với nước: Phản ứng chậm với nước để tạo thành praseodymi hydroxit
- Phản ứng với axit: Phản ứng với axit để tạo thành muối praseodymi
- Phản ứng với oxy: Phản ứng với oxy để tạo thành praseodymi oxit
- Hợp chất: Praseodymi tạo thành nhiều hợp chất khác nhau, bao gồm oxit, hydroxit, halide, cacbonat, sulfat, và nitrat.
Một số tính chất đặc trưng:
- Praseodymi có tính khử mạnh hơn europi, lanthan, xeri hay neodymi.
- Praseodymium chịu đựng sự ăn mòn trong không khí tốt hơn so với europium, lanthanum, cerium và neodymium..
- Praseodymi có thể tạo thành hợp chất với nhiều nguyên tố khác nhau.
- Praseodymi được sử dụng trong một số ứng dụng khác nhau, bao gồm:
- Hợp kim: Praseodymi được sử dụng trong một số hợp kim để cải thiện độ bền và khả năng chống ăn mòn.
- Laze: Praseodymi được sử dụng trong một số loại laze.
- Kính: Praseodymi được sử dụng để tạo ra một số loại kính màu.
- Phân tích hóa học: Praseodymi được sử dụng trong một số phương pháp phân tích hóa học.
Ứng dụng của nguyên tố Praseodymi

Hợp kim
- Praseodymi được sử dụng để tạo ra các hợp kim có độ bền cao, khả năng chống ăn mòn tốt và khả năng chịu nhiệt độ cao.
- Các hợp kim này được sử dụng trong các ngành công nghiệp như hàng không vũ trụ, ô tô, và năng lượng.
- Ví dụ: Hợp kim Mg-Pr được sử dụng trong động cơ máy bay vì có độ bền cao và trọng lượng nhẹ.
Laze
- Praseodymi được sử dụng trong một số loại laze, bao gồm laze Nd:YAG và laze Ti:sapphire.
- Các laze này được sử dụng trong nhiều ứng dụng khác nhau, bao gồm cắt, hàn, y tế và khoa học.
- Ví dụ: Laze Nd:YAG được sử dụng trong phẫu thuật để cắt bỏ mô và điều trị các bệnh về mắt.
Kính
- Praseodymi được sử dụng để tạo ra một số loại kính màu vàng và xanh lá cây.
- Kính này được sử dụng trong các ứng dụng như kính râm, kính lọc ánh sáng và kính trang trí.
- Ví dụ: Kính Praseodymi được sử dụng trong kính hàn để bảo vệ mắt khỏi tia UV và ánh sáng hồng ngoại.
Phân tích hóa học
- Praseodymi được sử dụng trong một số phương pháp phân tích hóa học để xác định các nguyên tố khác.
- Các phương pháp này được sử dụng trong nhiều lĩnh vực khác nhau, bao gồm khoa học môi trường, y tế và kiểm soát chất lượng.
- Ví dụ: Phân tích quang phổ phát xạ tia X sử dụng Praseodymi để xác định các nguyên tố khác trong mẫu.
Các ứng dụng khác
- Praseodymi được sử dụng trong một số ứng dụng khác, bao gồm:
- Pin nhiên liệu
- Nam châm vĩnh cửu
- Chất xúc tác
- Vật liệu quang học
- Lĩnh vực y tế
Điều chế và sản xuất nguyên tố Praseodymi
Điều chế
Điều chế trong phòng thí nghiệm:
- Praseodymi có thể được điều chế trong phòng thí nghiệm bằng phương pháp khử muối praseodymi(III) chloride (PrCl3) bằng kim loại kali hoặc natri:
2PrCl3 + 3K → 2Pr + 3KCl
- Phản ứng này được thực hiện trong bình kín dưới bầu khí quyển argon để tránh oxy hóa praseodymi.
Điều chế trong công nghiệp:
- Praseodymi được sản xuất trong công nghiệp bằng phương pháp khai thác và chiết xuất từ quặng monazit.
- Monazit là một loại khoáng vật chứa nhiều kim loại đất hiếm, bao gồm praseodymi.
- Quặng monazit được nghiền nhỏ và sau đó được xử lý bằng axit để hòa tan các kim loại đất hiếm.
- Dung dịch thu được được chiết xuất bằng dung môi để tách praseodymi khỏi các kim loại đất hiếm khác.
- Praseodymi sau đó được khử bằng kim loại kali hoặc natri để thu được kim loại nguyên chất.
Phương trình điều chế:
- Quá trình chiết xuất praseodymi từ quặng monazit có thể được mô tả bằng các phương trình hóa học sau:
Monazit + H2SO4 → Pr2(SO4)3 + …
Pr2(SO4)3 + 2SX → 2PrX3 + S2
2PrX3 + 3K → 2Pr + 3KX
- Trong đó:
- …: Các kim loại đất hiếm khác
- SX: Dung môi chiết xuất
- KX: Muối kali
Sản xuất
- Praseodymi được sản xuất trên toàn thế giới, với Trung Quốc là nhà sản xuất lớn nhất.
- Nhu cầu praseodymi đang tăng do việc sử dụng nó trong các ứng dụng mới như pin nhiên liệu và xe điện.
- Việc sản xuất praseodymi có thể gây ra một số tác động môi trường, bao gồm ô nhiễm nước và đất.
Lưu ý:
- Praseodymi là một kim loại đất hiếm và có thể gây ra một số nguy cơ an toàn nếu không được sử dụng cẩn thận.
- Cần tuân thủ các quy định an toàn khi làm việc với praseodymi.
- Nên tham khảo ý kiến chuyên gia trước khi sử dụng praseodymi trong các ứng dụng cụ thể.
Phản ứng của nguyên tố Praseodymi (Pr)

Phản ứng với oxy
- Praseodymi phản ứng với oxy trong không khí ở nhiệt độ cao (khoảng 150-175 °C) để tạo thành praseodymi(IV) oxide (PrO2):
4Pr + 3O2 → 2Pr2O3
- Praseodymi(IV) oxide là một chất rắn màu nâu sẫm, không tan trong nước. Nó có tính oxy hóa mạnh và có thể được sử dụng làm chất xúc tác trong nhiều phản ứng hóa học.
Phản ứng với nước
- Praseodymi kim loại phản ứng chậm với nước ở nhiệt độ phòng để tạo thành praseodymi(III) hydroxide (Pr(OH)3):
2Pr + 3H2O → 2Pr(OH)3 + 3H2
- Praseodymi(III) hydroxide là một chất rắn màu trắng, không tan trong nước.
Phản ứng với axit
- Praseodymi kim loại phản ứng với axit loãng để tạo thành muối praseodymi(III):
2Pr + 6HCl → 2PrCl3 + 3H2
- Muối praseodymi(III) thường có màu vàng hoặc cam.
Phản ứng với halogen
- Praseodymi kim loại phản ứng với halogen (như Cl2, Br2) ở nhiệt độ cao để tạo thành muối praseodymi(III) halide:
2Pr + 3Cl2 → 2PrCl3
- Muối praseodymi(III) halide thường có màu trắng.
Ví dụ cụ thể:
- Đốt cháy praseodymi: Khi đốt cháy praseodymi trong không khí, nó sẽ tạo ra một ngọn lửa màu vàng sáng và tạo ra khói màu nâu sẫm. Khói này là praseodymi(IV) oxide.
- Phản ứng của praseodymi với axit hydrochloric: Cho praseodymi kim loại vào dung dịch axit hydrochloric loãng sẽ thấy có khí hydro thoát ra và dung dịch chuyển sang màu vàng. Dung dịch này chứa muối praseodymi(III) chloride.
- Phản ứng của praseodymi với dung dịch kiềm: Cho praseodymi(III) chloride vào dung dịch NaOH sẽ thấy có kết tủa màu trắng xuất hiện. Kết tủa này là praseodymi(III) hydroxide.
Vấn đề an toàn khi sử dụng nguyên tố Praseodymi
Kích ứng da và mắt
- Praseodymi có thể gây kích ứng da và mắt. Các triệu chứng có thể bao gồm ngứa, đỏ, sưng tấy và đau.
- Nếu tiếp xúc với praseodymi, cần rửa sạch da và mắt với nước ngay lập tức.
- Nên đeo găng tay, kính bảo hộ và quần áo bảo hộ khi làm việc với praseodymi.
Hít phải
- Hít phải bụi hoặc khói praseodymi có thể gây kích ứng đường hô hấp. Các triệu chứng có thể bao gồm ho, khó thở, tức ngực và đau họng.
- Nên làm việc với praseodymi trong khu vực thông gió tốt.
- Nên đeo khẩu trang chống bụi khi làm việc với praseodymi dạng bột.
Nguy cơ cháy nổ
- Praseodymi kim loại có thể dễ dàng bắt lửa và cháy trong không khí.
- Cần cẩn thận khi sử dụng praseodymi gần nguồn nhiệt.
- Nên có sẵn bình chữa cháy hoặc các phương tiện chữa cháy khác khi làm việc với praseodymi.
Nguy cơ độc hại
- Praseodymi có thể gây độc nếu nuốt phải. Các triệu chứng có thể bao gồm buồn nôn, ói mửa, tiêu chảy và đau bụng.
- Nên bảo quản praseodymi ở nơi an toàn, tránh xa tầm tay trẻ em và vật nuôi.
- Nên rửa tay kỹ sau khi làm việc với praseodymi.
Trên đây là toàn bộ những kiến thức cơ bản về nguyên tố Praseodymi mà chúng tôi đã tổng hợp. Hãy cùng đọc và khám phá thêm về chủ đề này!
Chúng tôi hy vọng rằng bài viết đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về nguyên tố Praseodymi. Nếu bạn có bất kỳ câu hỏi hoặc muốn tìm hiểu thêm, đừng ngần ngại để lại comment dưới đây nhé!









